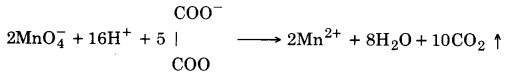
UP Board Solutions for Class 12 Chemistry Chapter 8 The d and f Block Elements (d-एवं f-ब्लॉक के तत्त्व)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
सिल्वर परमाणु की मूल अवस्था में पूर्ण भरित d कक्षक (4d10) हैं। आप कैसे कह सकते हैं कि यह एक संक्रमण तत्व है?
उत्तर
सिल्वर (Z = 47), +2 ऑक्सीकरण अवस्था भी प्रदर्शित कर सकता है तथा इस अवस्था में इसके 4d कक्षक अपूर्ण भरे हुए होते हैं, अत: यह एक संक्रमण तत्व है।
प्रश्न 2.
श्रेणी Sc (Z = 21) से Zn (Z = 30) में, जिंक की कणन एन्थैल्पी का मान सबसे कम अर्थात 128 kJ mol-1 होता है, क्यों?
उत्तर
जिंक के 3d कक्षकों के इलेक्ट्रॉन आबन्धन में प्रयुक्त नहीं होते हैं, जबकि 3d श्रेणी की शेष सभी धातुओं के d कक्षक के इलेक्ट्रॉन आबन्ध बनाने में प्रयुक्त होते हैं। इसलिए श्रेणी में जिंक की कणन एन्थैल्पी का मान सबसे कम होता है।
प्रश्न 3.
संक्रमण तत्वों की 3d श्रेणी का कौन-सा तत्व बड़ी संख्या में ऑक्सीकरण अवस्थाएँ दर्शाता है एवं क्यों?
उत्तर
मैंगनीज (Z = 25) के परमाणु में सर्वाधिक अयुग्मित इलेक्ट्रॉन पाए जाते हैं। अत: यह +2 से +7 तक ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है जो सबसे बड़ी संख्या है।
प्रश्न 4.
कॉपर के लिए E–(M2+| M), का मान धनात्मक (+0.34 V) है। इसके सम्भावित कारण क्या हैं?
[संकेत-इसके उच्च ΔaH– और ΔHyd H– पर ध्यान दें।]
उत्तर
किसी धातु के लिए E–(M2+| M), निम्नलिखित पदों में होने वाले एन्थैल्पी परिवर्तन के योग से सम्बद्ध होता है –
- M(s) + ΔaH → M(g) (ΔaH = परमाण्विक एन्थैल्पी = धनात्मक)
- M(g) + ΔiH → M2+ (g) (ΔiH = आयनन एन्थैल्पी = धनात्मक)
- M2+ (g) + (aq) → M2+ (aq) + ΔhydH (ΔhydH = जलयोजन एन्थैल्पी = ऋणात्मक)
कॉपर की परमाण्विक एन्थैल्पी, उच्च तथा जलयोजन एन्थैल्पी कम होती हैं। इसलिए E–(Cu2+| Cu) को मान धनात्मक होता है। अत: Cu(s) के Cu2+ (aq) में रूपान्तरण की उच्च ऊर्जा इसकी जलयोजन एन्थैल्पी द्वारा सन्तुलित नहीं होती है।
प्रश्न 5.
संक्रमण तत्वों की प्रथम श्रेणी में आयनन एन्थैल्पी (प्रथम और द्वितीय) में अनियमित परिवर्तन को आप कैसे समझाएँगे?
उत्तर
आयनन एन्थैल्पी में अनियमित परिवर्तन विभिन्न 3d विन्यासों के स्थायित्व की क्षमता में भिन्नता के कारण है (उदाहरण d0, d5, d10 असामान्य रूप से स्थायी होते हैं)।
प्रश्न 6.
कोई धातु अपनी उच्चतम ऑक्सीकरण अवस्था केवल ऑक्साइड अथवा फ्लुओराइड में ही क्यों प्रदर्शित करती है?
उत्तर
छोटे आकार एवं उच्च विद्युत ऋणात्मकता के कारण ऑक्सीजन अथवा फ्लुओरीन तत्व, धातु को उसकी उच्च ऑक्सीकरण अवस्था तेक ऑक्सीकृत कर सकते हैं।
प्रश्न 7.
Cr2+ और Fe2+ में से कौन प्रबल अपचायक है और क्यों?
उत्तर
Fe2+ की तुलना में Cr2+ एक प्रबल अपचायक पदार्थ है।
कारण– Cr2+ से Cr3+ बनने में d4 → d3 परिवर्तन होता है, किन्तु Fe2+ से Fe3+ में d6 → d5 में परिवर्तन होता है। जल जैसे माध्यम में d5 की तुलना में d3 अधिक स्थायी है।
प्रश्न 8.
M2+ (aq) आयन (Z = 27) के लिए ‘प्रचक्रण-मात्र चुम्बकीय आघूर्ण की गणना कीजिए।
उत्तर
M परमाणु (Z = 27) का इलेक्ट्रॉनिक विन्यास [Ar] 3d7 4s2 है।
∴ M2+ का इलेक्ट्रॉनिक विन्यास = [Ar] 3d7
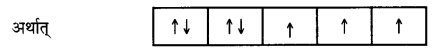
अतः इसमें तीन अयुग्मित इलेक्ट्रॉन हैं।
∴ ‘प्रचक्रेण-मात्र चुम्बकीय आघूर्ण (µ) = B.M. = B.M.
= B.M. = 3.87 B.M.
प्रश्न 9.
स्पष्ट कीजिए कि Cu’ आयन जलीय विलयन में स्थायी नहीं है, क्यों? समझाइए।
उत्तर
Cu+ (aq) से Cu2+ (aq) अधिक स्थायी होता है। इसका कारण यह है कि कॉपर की द्वितीय आयनन एन्थैल्पी अधिक होती है, परन्तु Cu2+ (aq) के लिए ΔhydH, Cu+ (aq) की तुलना में अधिक ऋणात्मक होती है, इसलिए यह कॉपर की द्वितीय आयनन एन्थैल्पी के लिए अधिक क्षतिपूर्ति करती है। अत: अनेक कॉपर (I) यौगिक जलीय विलयन में अस्थायी होते हैं तथा निम्नलिखित प्रकार असमानुपातित होते हैं –
2Cu+ (aq) → Cu2+ (aq) + Cu (S)
प्रश्न 10.
लैन्थेनाइड आकुंचन की तुलना में एक तत्व से दूसरे तत्व के बीच ऐक्टिनाइड आकुंचन अधिक होता है, क्यों?
उत्तर
5d इलेक्ट्रॉन नाभिकीय आवेश से प्रभावी रूप से परिरक्षित रहते हैं। दूसरे शब्दों में, 5d इलेक्ट्रॉनों की श्रेणी में एक तत्व से दूसरे तत्व की ओर जाने पर दुर्बल परिरक्षण प्रभाव परिलक्षित होता है। अतः ऐक्टिनाइड आकुंचन (संकुचन) अधिक होता है।
अतिरिक्त अभ्यास
प्रश्न 1.
निम्नलिखित के इलेक्ट्रॉनिक विन्यास लिखिए –
- Cr3+
- Pm3+
- Cu+
- Ce4+
- Co2+
- Lu2+
- Mn2+
- Th4+
उत्तर
- Cr3+ : [Ar] 3d3
- Pm3+ : [Xe] 4f4
- Cu+ : [Ar] 3d10
- Ce4+ : [Xe] 4f0
- Co2+ : [Ar] 3d7
- Lu2+ : [Xe] 4f14 5d1
- Mn2+ : [Ar] 3d5
- Th4+ : [Rn] 5f0
प्रश्न 2.
+3 ऑक्सीकरण अवस्था में ऑक्सीकृत होने के सन्दर्भ में Mn2+ के यौगिक Fe2+ के यौगिकों की तुलना में अधिक स्थायी क्यों हैं?
उत्तर
Mn2+ का इलेक्ट्रॉनिक विन्यास [Ar] 3d5 है, जबकि Fe2+ का [Ar] 3d6 है। चूंकि Mn2+ में अर्द्ध-पूर्ण कक्ष (3d5) होती है, जो कि Fe2+ की 3d6 कक्ष से अधिक स्थायी है, इसलिए Mn2+ यौगिक सरलता से Mn3+ में ऑक्सीकृत नहीं होते हैं क्योंकि इनकी द्वितीय आयनन एन्थैल्पी बहुत अधिक होती है। इसके विपरीत, Fe2+ यौगिक कम द्वितीय आयनन एन्थैल्पी के कारण Fe3+ में सरलता से ऑक्सीकृत हो जाता है। यही कारण है कि Mn2+ यौगिक अपनी +3 अवस्था के लिए ऑक्सीकरण के प्रति Fe2+ से अधिक स्थायी होते हैं।
प्रश्न 3.
संक्षेप में स्पष्ट कीजिए कि प्रथम संक्रमण श्रेणी के प्रथम अर्द्धभाग में बढ़ते हुए परमाणु क्रमांक के साथ +2 ऑक्सीकरण अवस्था कैसे अधिक स्थायी होती जाती है?
उत्तर
प्रथम संक्रमण श्रेणी में बायें से दाये जाने पर IE1 + IE2 का योग बढ़ता जाता है। इसके परिणामस्वरूप M2+ आयन बनाने की प्रवृत्ति घटती जाती है। यही कारण है कि श्रेणी के प्रथम अर्द्ध भाग में +2 अवस्था अधिकाधिक स्थायी होती है।
प्रश्न 4.
प्रथम संक्रमण श्रेणी के तत्वों के इलेक्ट्रॉनिक विन्यास किस सीमा तक ऑक्सीकरण अवस्थाओं को निर्धारित करते हैं? उत्तर को उदाहरण देते हुए स्पष्ट कीजिए।
उत्तर
जिस ऑक्सीकरण अवस्था में आयनों में पूर्ण भरी या अर्द्ध भरी d कक्ष होती है, वे आयन अधिक स्थायी होते हैं। जैसे Mn की +2 अवस्था इसकी अन्य ऑक्सीकरण अवस्थाओं की अपेक्षा अधिक स्थायी होती है। जैसे Mn की +2 अवस्था इसकी अन्य ऑक्सीकरण अवस्थाओं की अपेक्षा अधिक स्थायी होती है। क्योंकि Mn2+ में अर्द्ध भरी 3d5 कक्ष होती है। इसी प्रकार Zn की +2 अवस्था इसकी सबसे अधिक स्थायी अवस्था होती है क्योंकि इसमें पूर्ण भरी 3d10 कक्ष होती है।
प्रश्न 5.
संक्रमण तत्वों की मूल अवस्था में नीचे दिए गए d इलेक्ट्रॉनिक विन्यासों में कौन-सी ऑक्सीकरण अवस्था स्थायी होगी?
3d3, 3d5, 3d8 तथा 3d4
उत्तर
- 3d3 (वैनेडियम) : (+2), +3, +4, +5
- 3d5 (क्रोमियम) : +3, +4, +6
- 3d5 (मैंग्नीज) : +2, +4, +6, +7
- 3d8 (कोबाल्ट) : +2, +3
- 3d4 : इस विन्यास वाला कोई भी तत्त्व तलस्थ अवस्था में नहीं पाया जाता है।
प्रश्न 6.
प्रथम संक्रमण श्रेणी के ऑक्सो-धातुऋणायनों का नाम लिखिए, जिसमें धातु संक्रमण श्रेणी की वर्ग संख्या के बराबर ऑक्सीकरण अवस्था प्रदर्शित करती है।
उत्तर
Cr2O2-7 तथा CrO2-4 में क्रोमियम +6 अवस्था प्रदर्शित करता है, जो कि इसके समूह की संख्या (6) के बराबर है।
MnO–4 में Mn + 7 अवस्था प्रदर्शित करता है, जो कि इसकी समूह की संख्या (7) के बराबर है। VO–3 में V+ 5 अवस्था प्रदर्शित करता है, जो कि इसकी समूह की संख्या (5) के बराबर है।
प्रश्न 7.
लैन्थेनाइड आकुंचन क्या है? लैन्थेनाइड आकुंचन के परिणाम क्या हैं? (2015, 16, 17, 18)
उत्तर
लैन्थेनाइड आकुंचन (Lanthanoid Contraction) – लैन्थेनाइड श्रेणी में परमाणु क्रमांक बढ़ने पर परमाण्विक तथा आयनिक त्रिज्याएँ एक तत्व से दूसरे तत्व तक घटती हैं, परन्तु यह कमी अत्यन्त कम होती है। उदाहरणार्थ– Ce से Lu तक जाने पर परमाण्विक त्रिज्या 183 pm से 173 pm तक घट जाती है तथा यह कमी केवल 10 pm है। इसी प्रकार Ce3+ से Lu3+ आयन तक जाने पर आयनिक त्रिज्या 103 pm से घटकर 85 pm रह जाती है तथा यह कमी केवल 18 pm है। अत: परमाणु क्रमांक में 14 की वृद्धि के लिए, परमाण्विक तथा आयनिक त्रिज्याओं में होने वाली कमी अत्यन्त कम है। यह कमी अन्य वर्गों तथा आवर्तो के तत्वों की तुलना में अत्यल्प है।
सारणी-लैन्थेनम तथा लैन्थेनाइडों के परमाण्विक तथा
आयनिक त्रिज्याओं में परिवर्तन (pm)
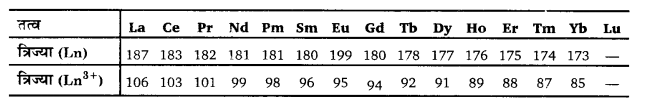
लैन्थेनाइड तत्वों में परमाणु क्रमांक बढ़ने पर उनके परमाणु तथा आयनिक आकारों में होने वाली स्थिर कमी ‘लैन्थेनाइड आकुंचन’ कहलाती है।
त्रिसंयोजी लैन्थेनॉइडों (Ln3+) की आयनिक त्रिज्याओं में कमी चित्र-1 में दर्शायी गई है।

लैन्थेनाइड आकुंचन का कारण (Cause of Lanthanide Contraction) – लेन्थेनाइड श्रेणी में एक तत्व से दूसरे तत्व तक जाने पर नाभिकीय आवेश एक इकाई बढ़ता है तथा एक इलेक्ट्रॉन जुड़ता है। ये नए इलेक्ट्रॉन समानान्तर 4f- उपकोशों में जुड़ते हैं। यद्यपि एक 4f- इलेक्ट्रॉन का दूसरे 4f- इलेक्ट्रॉन पर परिरक्षण प्रभाव (नाभिकीय आवेश से), f- कक्षकों के अत्यन्त विस्तृत आकार के कारण, कम होता है। यद्यपि नाभिकीय आवेश प्रत्येक पद पर एक इकाई बढ़ जाता है, इसलिए परमाणु क्रमांक तथा नाभिकीय आवेश बढ़ने पर प्रत्येक 4f- इलेक्ट्रॉन द्वारा अनुभव किया जाने वाला प्रभावी नाभिकीय आवेश बढ़ जाता है, परिणामस्वरूप सम्पूर्ण 4f- इलेक्ट्रॉन कोश प्रत्येक तत्व के जुड़ने पर आकुंचित हो जाता है, यद्यपि यह कमी अत्यन्त अल्प होती है। इसके परिणामस्वरूप परमाणु क्रमांक बढ़ने पर लैन्थेनाइडों के आकार में नियमित हस पाया जाता है। क्रमिक अपचयनों का योग कुल लैन्थेनाइड आकुंचन देता है।
लैन्थेनाइड आकुंचन के परिणाम (Consequences of Lanthanide Contraction) – लैन्थेनाइड आकुंचन के महत्त्वपूर्ण परिणाम निम्नलिखित हैं –
(1) द्वितीय तथा तृतीय संक्रमण श्रेणियों की समानता (Resemblance of second and third transition series) – आवर्त सारणी में लैन्थेनाइडों से पहले तथा बाद में आने वाले तत्वों के
आपेक्षिक गुणों पर इसका महत्त्वपूर्ण प्रभाव पड़ता है। अग्रलिखित सारणी से स्पष्ट होता है कि Sc से Y तथा Y से La तक आकार में नियमित वृद्धि होती है।
सारणी- d-ब्लॉक के तत्वों की परमाणु त्रिज्याएँ (pm में)

लैन्थेनाइड आकुंचन
इसी प्रकार हम अन्य वर्गों में आकार में सामान्य वृद्धि की अपेक्षा कर सकते हैं, यद्यपि लैन्थेनाइडों के पश्चात् द्वितीय से तृतीय संक्रमण श्रेणियों में त्रिज्याओं की वृद्धि लगभग नगण्य होती है।
Ti → Zr → Hf
V → Nb → Ta आदि
तत्वों के युग्मों; जैसे- Zr – Hf, Nb – Ta, Mo – W आदि के आकार समान (लगभग) होते हैं तथा इन तत्वों के गुण भी समान होते हैं। अत: लैन्थेनाइड आकुंचन के परिणामस्वरूप द्वितीय तथा तृतीय संक्रमण श्रेणियों के तत्व, प्रथम तथा द्वितीय संक्रमण श्रेणियों के तत्वों की तुलना में परस्पर अत्यधिक समानता रखते हैं।
(2) लैन्थेनाइडों में समानता (Similarity among lanthanides) – लैन्थेनाइडों की त्रिज्याओं में अत्यन्त अल्प-परिवर्तन के कारण, इनके रासायनिक गुण लगभग समान होते हैं। अतः तत्वों को शुद्ध अवस्था में पृथक्कृत करना अत्यन्त कठिन होता है। पुनरावृत्त प्रभाजी क्रिस्टलन अथवा आयन-विनिमय तकनीकों पर आधारित आधुनिक विधियों द्वारा इनके त्रिसंयोजी आयनों के आकारों में अत्यल्प-अन्तर के आधार पर इन्हें पृथक्कृत किया जाता है। इन विधियों द्वारा तत्वों के गुणों जैसे विलेयता, संकुल आयन निर्माण, जलयोजन आदि में बहुत कम अन्तर के आधार पर इन्हें पृथक्कृत किया जाता है।
(3) क्षारकता अन्तर (Basicity differences) – लैन्थेनाइड आकुंचन के कारण लैन्थेनाइड आयनों का आकार, परमाणु क्रमांक बढ़ने के साथ नियमित रूप से घटता है। आकार में कमी के फलस्वरूप लैन्थेनाइड आयन तथा OH आयनों के मध्य इनके सहसंयोजक गुण La3+ से Lu3+ तक बढ़ते हैं, इसलिए परमाणु क्रमांक बढ़ने पर हाइड्रॉक्साइडों की क्षारकीय सामर्थ्य घटती है। अत: La(OH)3 अधिकतम क्षारकीय है, जबकि Lu(OH)3 सबसे कम क्षारकीय है।
प्रश्न 8.
संक्रमण धातुओं के अभिलक्षण क्या हैं? ये संक्रमण धातु क्यों कहलाती हैं? d- ब्लॉक के तत्वों में कौन-से तत्व संक्रमण श्रेणी के तत्व नहीं कहे जा सकते?
उत्तर
संक्रमण धातुओं के सामान्य अभिलक्षण (General Characteristics of Transition Elements) – संक्रमण धातुओं (d-ब्लॉक के तत्वों) के सामान्य अभिलक्षण निम्नलिखित हैं –
- लगभग सभी संक्रमण तत्व अभिधात्विक गुण जैसे उच्च तनन सामर्थ्य (tensile strength), तन्यता (ductility), वर्धनीयता (malleability), उच्च तापीय तथा विद्युत चालकता तथा धात्विक चमक दर्शाते हैं।
- मर्करी को छोड़कर, जो कमरे के ताप पर द्रव है, अन्य संक्रमण तत्वों की अभिधात्विक संरचनाएँ होती हैं।
- इनके गलनांक तथा क्वथनांक उच्च होते हैं तथा असंक्रमण तत्वों की तुलना में इनकी वाष्पन ऊष्मा उच्च होती है।
- s- ब्लॉक तत्वों की तुलना में संक्रमण तत्वों के घनत्व उच्च होते हैं।
- d- ब्लॉक के तत्वों की प्रथम आयनन ऊर्जाएँ 5-ब्लॉक के तत्वों से अधिक, परन्तु p-ब्लॉक के तत्वों से कम होती हैं।
- इनकी प्रवृत्ति विद्युत धनात्मक होती है।
- इनमें से अधिकांश तत्व रंगीन यौगिक बनाते हैं।
- इनमें संकुल बनाने की प्रवृत्ति अत्यधिक होती है।
- ये अनेक ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं।
- इनके यौगिक सामान्यतया अनुचुम्बकीय प्रवृत्ति के होते हैं।
- ये अन्य धातुओं के साथ मिश्रधातु (alloy) बनाते हैं।
- ये कुछ तत्वों; जैसे हाइड्रोजन, बोरॉन, कार्बन, नाइट्रोजन आदि के साथ अन्तराकाशी यौगिक बनाते हैं।
- अधिकांश संक्रमण धातुएँ जैसे Mn, Ni, Co, Cr, V, Pt आदि तथा इनके यौगिक उत्प्रेरकों के रूप में प्रयुक्त किए जाते हैं।
d- ब्लॉक के तत्व संक्रमण धातुएँ कहलाते हैं क्योंकि ये तत्व अधिक विद्युत-धनात्मक 5-ब्लॉक के तत्वों तथा कम विद्युत-धनात्मक s- ब्लॉक के तत्वों से मध्यवर्ती गुण प्रदर्शित करते हैं तथा आवर्त सारणी में इनका स्थान s- तथा p- ब्लॉक के तत्वों के मध्य में है।
Zn, Cd तथा Hg का इलेक्ट्रॉनिक विन्यास सामान्य सूत्र (n – 1)d10 ns2 से प्रदर्शित किया जाता है। इन तत्वों में कक्षक तलस्थ (सामान्य) अवस्था में तथा साधारण ऑक्सीकरण अवस्थाओं में भी पूर्णपूरित होते हैं अर्थात् इनकी परमाण्विक अवस्था अथवा किसी भी एक आयनिक अवस्था में उपकोश अपूर्ण नहीं होते हैं, इसलिए इन्हें संक्रमण तत्व नहीं कहा जा सकता।
प्रश्न 9.
संक्रमण धातुओं के इलेक्ट्रॉनिक विन्यास किस प्रकार असंक्रमण तत्वों के इलेक्ट्रॉनिक विन्यास से भिन्न हैं?
उत्तर
संक्रमण तत्त्वों के इलेक्ट्रॉनिक विन्यास (n – 1)d1 – 10 ns1 – 2 प्रकार के होते हैं तथा इस प्रकार इनमें अपूर्ण d-ऑर्बिटल होती है जबकि असंक्रमण तत्त्वों में d-ऑर्बिटल नहीं पायी जाती है। इनके इलेक्ट्रॉनिक विन्यास ns1 – 2 या ns2 np1 – 6 प्रकार के होते हैं।
प्रश्न 10.
लैन्थेनाइडों द्वारा कौन-कौन सी ऑक्सीकरण अवस्थाएँ प्रदर्शित की जाती हैं? (2014)
उत्तर
लैन्थेनाइडों की ऑक्सीकरण अवस्थाएँ (Oxidation States of Lanthanides) – आवर्त सारणी के वर्ग 3 के सदस्यों से प्रत्याशित होता है कि लेन्थेनाइडों की एकसमान +3 ऑक्सीकरण अवस्था उनकी एक विशेषता है। त्रिधनात्मक ऑक्सीकरण अवस्था 6s2 इलेक्ट्रॉन और एकाकी 5d-इलेक्ट्रॉन अथवा यदि कोई 5d- इलेक्ट्रॉन उपस्थित न हो तो f- इलेक्ट्रॉनों में से एक के उपयोग के अनुसार होती है। प्रथम तीन आयनन एन्थैल्पियों का योग अपेक्षाकृत निम्न होता है जिससे ये तत्व उच्च धनविद्युती होते हैं और तत्परता से +3 आयन बना लेते हैं। यद्यपि जलीय विलयन में तथा ठोस अवस्था में सीरियम (Ce4+) चर्तुधनात्मक तथा सैमेरियम, यूरोपियम और इटर्बियम (Sm2+, Eu2+ और Yb2+) द्विधनात्मक आयन दे सकते हैं। अन्य तत्व ठोस अवस्था में +4 अवस्था दे सकते हैं। MX3 का अपचयन न केवल MX2 अपितु विशेष स्थिति में जटिल अपचयित स्पीशीज भी दे सकता है।
लैन्थेनाइडों के लिए +3 ऑक्सीकरण अवस्था की धारणा पर्याप्त दृढ़ हो गई है तथा अन्य ऑक्सीकरण अवस्थाओं को प्रायः असंगत’ कहा जाता है। विभिन्न लैन्थेनाइडों की ऐसी असंगत ऑक्सीकरण अवस्थाएँ अग्र प्रकार प्रदर्शित की गई हैं –

यदि हम यह मान लें कि रिक्त, अर्द्धपूर्ण या पूर्ण f- उपकोश के साथ विशेष स्थायित्व सम्बन्धित होता है। तो एक निश्चित सीमा तक +2 तथा +4 ऑक्सीकरण अवस्थाओं की उपस्थिति का इलेक्ट्रॉनिक संरचनाओं के साथ सामंजस्य किया जा सकता है। इस प्रकार La, Gd और Lu केवल त्रिधनात्मक आयन निर्मित करते हैं क्योंकि तीन इलेक्ट्रॉनों के निष्कासन से La3+ आयन में उत्कृष्ट गैस का विन्यास बन जाता है। Gd3+ तथा Lu3+ आयनों में क्रमशः स्थायी विन्यास 4f7 तथा 4f14 से इलेक्ट्रॉनों का निष्कासन नहीं होता क्योंकि M3+ आयनों की अपेक्षा M2+ अथवा M+ आयनों की जालक अथवा जलयोजन ऊर्जाएँ लघु M3+ आयनों के लवणों की योगात्मक जालक या जलयोजन ऊर्जाओं की अपेक्षा कम होगी।
सबसे अधिक स्थायी द्वि या चतुर्धनात्मक आयन उन तत्वों द्वारा निर्मित होते हैं जो ऐसा करके f9, f7 तथा f14 विन्यास प्राप्त कर सकते हों। इस प्रकार सीरियम +4 ऑक्सीकरण अवस्था में आकर f0 विन्यास प्राप्त कर लेता है। यूरोपियम तथा इटर्बियम +2 ऑक्सीकरण अवस्था में क्रमशः f7 तथा f14 विन्यास प्राप्त कर लेते हैं। ये तथ्य इस धारणा का समर्थन करते प्रतीत होते हैं कि लैन्थेनाइडों के लिए +3 के अतिरिक्त दूसरी ऑक्सीकरण अवस्थाओं का अस्तित्व निर्धारित करने में f0, f7 तथा f14 विन्यासों का विशेष स्थायित्व महत्त्वपूर्ण है, परन्तु यह तर्क कम निर्णयात्मक हो जाता है जब हम देखते हैं कि सैमेरियम और थूलियम f6 तथा f13 विन्यास रखते हुए M2+ आयन बनाते हैं, M+ आयन नहीं।
साथ ही प्रेजियोडिमियम एवं नियोडिमियम f1 तथा f2 विन्यासों के साथ M4+ आयन बनाते हैं, परन्तु कोई पंच या षट-संयोजक प्रकार के आयन नहीं बनाते। इसमें सन्देह नहीं है कि Sm (II) और विशेषकर Tm (II), Pr (IV) तथा Nd (IV) अवस्थाएँ बहुत अस्थायी हैं, परन्तु यह विचार भी संदिग्ध है कि f0, f7 या f14 विन्यास के केवल समीप पहुँच जाना भी स्थायित्व के लिए सहायक होता है चाहे ऐसा कोई विन्यास वस्तुतः प्राप्त नहीं भी हो। Nd2+ (f4) का अस्तित्व यह विश्वास करने के लिए विशेष निर्णयात्मक प्रमाण है कि यद्यपि f0, f7, f14 विन्यास का स्थायित्व ऑक्सीकरण अवस्थाओं का स्थायित्व निर्धारण करने में एक घटक हो सकता है, यद्यपि अन्य ऊष्मागतिकीय तथा गतिकीय घटक विशेष भी हैं जिनका समान या अधिक महत्त्व है।
प्रश्न 11.
कारण देते हुए स्पष्ट कीजिए –
- संक्रमण धातुएँ तथा उनके अधिकांश यौगिक अनुचुम्बकीय हैं। (2014, 18)
- संक्रमण धातुओं की कणन एन्थैल्पी के मान उच्च होते हैं।
- संक्रमण धातुएँ सामान्यतः रंगीन यौगिक बनाती हैं।
- संक्रमण धातुएँ तथा इनके अनेक यौगिक उत्तम उत्प्रेरक का कार्य करते हैं।
उत्तर
1. पदार्थों में अनुचुम्बकत्व की उत्पत्ति, अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण होती है। प्रतिचुम्बकीय पदार्थ वे होते हैं जिनमें सभी इलेक्ट्रॉन युग्मित होते हैं। संक्रमण धातु आयनों में प्रतिचुम्बकत्व तथा अनुचुम्बकत्व दोनों होते हैं अर्थात् इनमें दो विपरीत प्रभाव पाए जाते हैं, इसलिए परिकलित चुम्बकीय आघूर्ण इनका परिणामी चुम्बकीय आघूर्ण माना जाता है। d0 (Sc3+, Ti4+) या d10 (Cu+, Zn2+) विन्यासों को छोड़कर, संक्रमण धातुओं के सभी सरल आयनों में इनके (n – 1) d उपकोशों में अयुग्मित इलेक्ट्रॉन होते हैं; अत: ये अधिकांशत: अनुचुम्बकीय होते हैं। ऐसे अयुग्मित इलेक्ट्रॉन का चुम्बकीय आघूर्ण, प्रचक्रण कोणीय संवेग तथा कक्षीय कोणीय संवेग से सम्बन्धित होता है। प्रथम संक्रमण श्रेणी की धातुओं के यौगिकों में कक्षीय कोणीय संवेग को योगदान प्रभावी रूप से शमित (quench) हो जाता है, इसलिए इसका कोई महत्त्व नहीं रह जाता।
अत: इनके लिए चुम्बकीय आघूर्ण का निर्धारण उसमें उपस्थित अयुग्मित इलेक्ट्रॉनों की संख्या के आधार पर किया जाता है तथा इसकी गणना निम्नलिखित ‘प्रचक्रण मात्र’ सूत्र द्वारा की जाती है-
μ =
यहाँ n अयुग्मित इलेक्ट्रॉनों की संख्या है तथा ॥ चुम्बकीय आघूर्ण है जिसका मात्रक बोर मैग्नेटॉन (BM) है। अतः एक अयुग्मित इलेक्ट्रॉन का चुम्बकीय आघूर्ण 1.73 BM होता है।
2. संक्रमण धातुओं की कणन एन्थैल्पी के मान उच्च होते हैं क्योंकि इनके परमाणुओं में अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होती है। इस कारण इनमें प्रबल अन्तरापरमाण्विक अन्योन्य-क्रियाएँ होती हैं। तथा इसलिए परमाणुओं के मध्य प्रबल आबन्ध उपस्थित होते हैं।
3. अधिकांश संक्रमण धातु आयन विलयन तथा ठोस अवस्थाओं में रंगीन होते हैं। ऐसा दृश्य प्रकाश के आंशिक अवशोषण के कारण होता है। अवशोषित प्रकाश इलेक्ट्रॉन को समान d-उपकोश के एक कक्षक से दूसरे कक्षक में उत्तेजित कर देता है। चूंकि इलेक्ट्रॉनिक संक्रमण धातु आयनों के d-कक्षकों में होते हैं, इसलिए ये d-d संक्रमण कहलाते हैं। संक्रमण धातु आयनों में दृश्य प्रकाश को अवशोषित करके होने वाले d-d संक्रमणों के कारण ही ये रंगीन दिखाई देते हैं।
4. संक्रमण धातुएँ तथा इनके यौगिक उत्प्रेरकीय सक्रियता के लिए जाने जाते हैं। संक्रमण धातुओं का यह गुण उनकी परिवर्तनशील संयोजकता एवं संकुल यौगिक के बनाने के गुण के कारण है। वैनेडियम (V) ऑक्साइड (संस्पर्श प्रक्रम में), सूक्ष्म विभाजित आयरन (हेबर प्रक्रम में) और निकिल (उत्प्रेरकीय हाइड्रोजनीकरण में) संक्रमण धातुओं के द्वारा उत्प्रेरण के कुछ उदाहरण हैं। उत्प्रेरक के ठोस पृष्ठ पर अभिकारक के अणुओं तथा उत्प्रेरक की सतह के परमाणुओं के बीच आबन्धों की रचना होती है। आबन्ध बनाने के लिए प्रथम संक्रमण श्रेणी की धातुएँ 3d एवं 4s इलेक्ट्रॉनों का उपयोग करती हैं, परिणामस्वरूप उत्प्रेरक की सतह पर अभिकारक की सान्द्रता में वृद्धि हो जाती है तथा अभिकारक के अणुओं में उपस्थित आबन्ध दुर्बल हो जाते हैं। इन कारण सक्रियण ऊर्जा का मान घटे जाता है। ऑक्सीकरण अवस्थाओं में परिवर्तन हो सकने के कारण संक्रमण धातुएँ उत्प्रेरक के रूप में अधिक प्रभावी होती हैं।
उदाहरणार्थ– आयरन (III), आयोडाइड आयन तथा परसल्फेट आयन के बीच सम्पन्न होने वाली अभिक्रिया को उत्प्रेरित करता है।
- 2I– + S2O2-8 → I2 ↑ + 2SO2-4
इस उत्प्रेरकीय अभिक्रिया का स्पष्टीकरण इस प्रकार है –
- 2Fe3+ + 2I– → 2Fe2+ +I2 ↑
- 2Fe2+ + S2O2-8 → 2Fe3+ + 2SO2-4
प्रश्न 12.
अन्तराकाशी यौगिक क्या हैं? इस प्रकार के यौगिक संक्रमण धातुओं के लिए भली प्रकार से ज्ञात क्यों हैं?
उत्तर
वे यौगिक जिनके क्रिस्टल जालक में अन्तराकाशी स्थलों को छोटे आकार वाले परमाणु अध्यासित कर लेते हैं, अन्तराकाशी यौगिक कहलाते हैं। अन्तराकाशी यौगिक संक्रमण धातुओं के लिए भली प्रकार से ज्ञात होते हैं क्योंकि संक्रमण धातुओं के क्रिस्टल जालकों में उपस्थित रिक्तियों (voids) में छोटे आकार वाले परमाणु; जैसे- H, N या C सरलता से सम्पाशित हो जाते हैं।
प्रश्न 13.
संक्रमण धातुओं की ऑक्सीकरण अवस्थाओं में परिवर्तनशीलता असंक्रमण धातुओं में ऑक्सीकरण अवस्थाओं में परिवर्तनशीलता से किस प्रकार भिन्न है? उदाहरण देकर स्पष्ट कीजिए।
उत्तर
संक्रमण धातुओं में ऑक्सीकरण अवस्था +1 से एक के क्रमिक परिवर्तन से उच्च अवस्थाओं में परिवर्तित होती है। जैसे, मैंगनीज में यह +2, +3, +4, +5, +6, +7 पायी जाती है। असंक्रमण धातुओं में परिवर्तन चयनात्मक होता है तथा सामान्य रूप से 2 के अन्तर से परिवर्तित होता है, जैसे क्लोरीन में परिवर्तन क्रम -1, +1,+3, +5, +7 है।
प्रश्न 14.
आयरन क्रोमाइट अयस्क से पोटैशियम डाइक्रोमेट बनाने की विधि का वर्णन कीजिए। पोटैशियम डाइक्रोमेट विलयन पर pH बढ़ाने से क्या प्रभाव पड़ेगा? (2016, 18)
उत्तर
पोटैशियम डाइक्रोमेट बनाने की विधि (Method of Preparation of Potassium Dichromate) – आयरन क्रोमाइट अयस्क (FeCr2O4) को जब वायु की उपस्थिति में सोडियम यो पोटैशियम कार्बोनेट के साथ संगलित किया जाता है तो क्रोमेट प्राप्त होता है।
4FeCr2O4 + 8Na2CO3 + 7O2 → 8Na2CrO4 +2Fe2O3 + 8CO2 ↑
सोडियम क्रोमेट के पीले विलयन को छानकर उसे सल्फ्यूरिक अम्ल द्वारा अम्लीय बना लिया जाता है। जिसमें से नारंगी सोडियम डाइक्रोमेट, Na2Cr2O7 . 2H2O को क्रिस्टलित कर लिया जाता है।
2Na2CrO4 + 2H+ → Na2Cr2O7 + 2Na+ + H2O
सोडियम डाइक्रोमेट की विलेयता, पोटैशियम डाइक्रोमेट से अधिक होती है, इसलिए सोडियम डाइक्रोमेट के विलयन में पोटैशियम क्लोराइड डालकर पोटैशियम डाइक्रोमेट प्राप्त कर लिया जाता है।
Na2Cr2O7 + 2KCl → K2Cr2O7 + 2NaCl
पोटैशियम डाइक्रोमेट के नारंगी रंग के क्रिस्टल, क्रिस्टलीकृत हो जाते हैं। जलीय विलयन में क्रोमेट तथा डाइक्रोमेट का अन्तरारूपान्तरण होता है जो विलयन के pH पर निर्भर करता है। क्रोमेट तथा डाइक्रोमेट में क्रोमियम की ऑक्सीकरण संख्या समान है।
2CrO2-4 + 2H+ → Cr2O2-7 + H2O
Cr2O2-7 + 2OH– → 2CrO2-4 + H2O
अत: pH बढ़ाने पर, अर्थात् विलयन को क्षारीय करने पर, डाइक्रोमेट आयन (नारंगी रंग) क्रोमेट आयनों में परिवर्तित हो जाते हैं तथा विलयन का रंग पीला हो जाता है।
प्रश्न 15.
पोटैशियम डाइक्रोमेट की ऑक्सीकरण क्रिया का उल्लेख कीजिए तथा निम्नलिखित के साथ आयनिक समीकरण लिखिए-
- आयोडाइड आयन
- आयरन (II) विलयन
- H2S.
उत्तर
पोटैशियम डाइक्रोमेट प्रबल ऑक्सीकारक के रूप में कार्य करता है। इसका उपयोग आयतनमितीय विश्लेषण में प्राथमिक मानक के रूप में किया जाता है। अम्लीय माध्यम में डाइक्रोमेट आयन की ऑक्सीकरण क्रिया निम्नलिखित प्रकार से प्रदर्शित की जा सकती है –
Cr2O2-7 + 14H+ + 6e– → 2Cr3+ + 7H2O (E– = 1: 33 V)
आयनिक अभिक्रियाएँ (Ionic Reactions)
- आयोडाइड आयन के साथ (With iodide ion) –
- Cr2O2-7 + 14H+ + 6I– → 2Cr3+ + 7H2O + 3I2 ↑
- आयरन (II) विलयन के साथ (With Iron (II) solution)
- Cr2O2-7 + 14H+ + 6Fe2+ → 2Cr3+ + 7H2O + 6Fe3+
- H2S के साथ (With H2S)
- Cr2O2-7 + 8H+ + 3H2S → 2Cr3+ + 7H2O + 3S ↓
प्रश्न 16.
पोटैशियम परमैंगनेट को बनाने की विधि का वर्णन कीजिए। अम्लीय पोटैशियम परमैंगनेट किस प्रकार (2016)
- आयरन (II) आयन,
- SO2 तथा
- ऑक्सैलिक अम्ल से अभिक्रिया करता है? अभिक्रियाओं के लिए आयनिक समीकरण लिखिए। (2018)
उत्तर
पोटैशियम परमैंगनेट, KMnO4 (Potassium Permanganate, KMnO4) बनाने की विधि (Method of Preparation) – पोटैशियम परमैंगनेट को निम्नलिखित विधियों से। बनाया जा सकता है –
1. पोटैशियम परमैंगनेट को प्राप्त करने के लिए MnO2 को क्षारीय धातु हाइड्रॉक्साइड तथा KNO3 जैसे ऑक्सीकारक के साथ संगलित किया जाता है। इससे गाढ़े हरे रंग का उत्पाद K2MnO4 प्राप्त होता है जो उदासीन या अम्लीय माध्यम में असमानुपातित होकर पोटैशियम परमैंगनेट देता है।
2MnO2 + 4KOH + O2 → 2K2MnO4 + 2H2O
3MnO2-4 + 4H+ → 2MnO–4 + MnO2 + 2H2O
2. औद्योगिक स्तर पर इसका उत्पादन MnO2 के क्षारीय ऑक्सीकरणी संगलन के पश्चात् मैंगनेट (VI) के विद्युत-अपघटनी ऑक्सीकरण द्वारा किया जाता है।

3. प्रयोगशाला में मैंगनीज (II) आयन के लवण परऑक्सीडाइसल्फेट द्वारा ऑक्सीकृत होकर परमैंगनेट बनाते हैं।
2Mn2+ + 5S2O2-8 + 8H2O → 2MnO–4 + 10SO2-4 + 16H+
रासायनिक अभिक्रियाएँ (Chemical Reactions)
अम्लीय पोटैशियम परमैंगनेट की रासायनिक अभिक्रियाएँ निम्नलिखित हैं –
- आयरन (II) आयन के साथ (With Iron (II) ion)
- MnO–4 + 8H+ + 5Fe2+ → Mn2+ + 4H2O + 5Fe3+
- SO2 के साथ (With SO2)
- 2MnO4 + 2H2O + 5SO2 → 2Mn2+ + 4H+ + 5SO2-4
- ऑक्सैलिक अम्ल के साथ (With oxalic acid)
प्रश्न 17.
M2+ | M तथा M3+ | M2+ निकाय के सन्दर्भ में कुछ धातुओं के E– के मान नीचे दिए गए हैं।
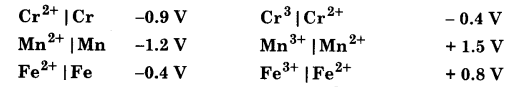
उपर्युक्त आँकड़ों के आधार पर निम्नलिखित पर टिप्पणी कीजिए –
- अम्लीय माध्यम में Cr3+ या Mn3+ की तुलना में Fe3+ का स्थायित्व।
- समान प्रक्रिया के लिए क्रोमियम अथवा मैंगनीज धातुओं की तुलना में आयरन के ऑक्सीकरण में सुगमता।
उत्तर
- Cr3+ / Cr2+ के लिए E का मान ऋणात्मक है। इसलिए Cr3+ स्थायी है तथा Cr2+ में अपचयित नहीं हो सकता है।
Mn3+ / Mn2+ के लिए E– का मान अधिक धनात्मक है, इसलिए Mn3+ बहुत स्थायी नहीं है तथा सरलता से Mn2+ में अपचयित हो सकता है। Fe3+ / Fe2+ के लिए E– का मान कम धनात्मक लेकिन छोटा है। इसलिए Fe3+, Mn3+ से अधिक स्थायी है। लेकिन यह Cr2+ से कम स्थायी है। - Fe, Cr तथा Mn के लिए ऑक्सीकरण विभव क्रमशः +0.4 V, + 0.9 V तथा +1.2 V है। इसलिए इनके ऑक्सीकरण की सुलभता का क्रम Mn > Cr > Fe होगा।
प्रश्न 18.
निम्नलिखित में कौन-से आयन जलीय विलयन में रंगीन होंगे?
Ti3+, V3+, Cu+, Sc3+, Mn2+, Fe3+ तथा Co2+ प्रत्येक के लिए कारण बताइए।
उत्तर
वे आयन रंगीन होते हैं जिनमें एक या अधिक अयुग्मित इलेक्ट्रॉन होते हैं। Ti3+, V3+, Mn2+, Fe3+ तथा Co2+ रंगीन होते हैं। Cu+ तथा Sc3+ रंगहीन होते हैं।
प्रश्न 19.
प्रथम संक्रमण श्रेणी की धातुओं की +2 ऑक्सीकरण अवस्थाओं के स्थायित्व की तुलना कीजिए।
उत्तर
प्रथमें संक्रमण श्रेणी के प्रथम अर्द्धभाग में बढ़ते हुए परमाणु क्रमांक के साथ प्रथम तथा द्वितीय आयनन एन्थैल्पियों का योग बढ़ता है। अत: मानक अपचायक विभव (E–) कम तथा ऋणात्मक होता है। इसलिए M2+ आयन बनाने की प्रवृत्ति घटती है। अत: +2 ऑक्सीकरण अवस्था प्रथम अर्द्ध-भाग में अधिक स्थायी होती है। +2 ऑक्सीकरण अवस्था का अधिक स्थायित्व, Mn2+ में अर्द्धपूरित d-उपकोशों (d5) के कारण, Zn2+ में पूर्णपूरित d-उपकोशों (d10) के कारण तथा निकिल में उच्च ऋणात्मक जलयोजन एन्थैल्पी के कारण होता है।
प्रश्न 20.
निम्नलिखित के सन्दर्भ में लैन्थेनाइड एवं ऐक्टिनाइड के रसायन की तुलना कीजिए –
- इलेक्ट्रॉनिक विन्यास
- परमाण्वीय एवं आयनिक आकार
- ऑक्सीकरण अवस्था
- रासायनिक अभिक्रियाशीलता।
उत्तर
1. इलेक्ट्रॉनिक विन्यास (Electronic configuration) – लैन्थेनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Xe]54 4f1-14 5d0-1 6s2 होता है, जबकि ऐक्टिनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Rn]86 5f1-14 6d1-2 7s2 होता है। अतः लैन्थेनाइड 4f श्रेणी से तथा ऐक्टिनाइड 5f श्रेणी से सम्बद्ध होते हैं।
2. परमाण्वीय एवं आयनिक आकार (Atomic and ionic sizes) – लैन्थेनाइड तथा ऐक्टिनाइड दोनों +3 ऑक्सीकरण अवस्था में अपने परमाणुओं अथवा आयनों के आकारों में कमी प्रदर्शित करते हैं। लैन्थेनाइडों में यह कमी लैन्थेनाइड आकुंचन कहलाती है, जबकि ऐक्टिनाइडों में यह ऐक्टिनाइड आकुंचन कहलाती है। यद्यपि ऐक्टिनाइडों में एक तत्व से दूसरे तत्व तक 5f-इलेक्ट्रॉनों द्वारा अत्यन्त कम परिरक्षण प्रभाव के कारण आकुंचन उत्तरोत्तर बढ़ता है।
3. ऑक्सीकरण अवस्था (Oxidation states) – लैन्थेनाइड सीमित ऑक्सीकरण अवस्थाएँ (+2, + 3, +4) प्रदर्शित करते हैं जिनमें +3 ऑक्सीकरण अवस्था सबसे अधिक सामान्य है। इसका कारण 4f, 5d तथा 6s उपकोशों के बीच अधिक ऊर्जा-अन्तर होना है। दूसरी ओर ऐक्टिंनाइड अधिक संख्या में ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं क्योंकि 5f,6d तथा 7s उपकोशों में ऊर्जा-अन्तर कम होता है।
4. रासायनिक अभिक्रियाशीलता (Chemical reactivity) – लैन्थेनाइड (Lanthanides) सामान्य रूप से श्रेणी के आरम्भ वाले सदस्य अपने रासायनिक व्यवहार में कैल्सियम की तरह बहुत क्रियाशील होते हैं, परन्तु बढ़ते परमाणु क्रमांक के साथ ये ऐलुमिनियम की तरह व्यवहार करते हैं।
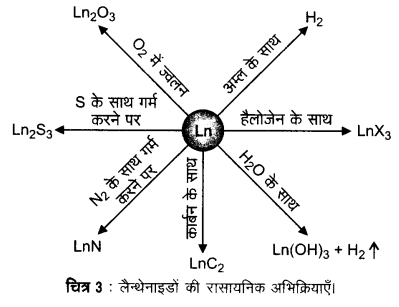
अर्द्ध- अभिक्रिया Ln3+ (aq) + 3e– → Ln(s) के लिए E– का मान -2.2 V से -2.4 V के परास में है। Eu के लिए E– का मान -2.0 V है। निस्सन्देह मान में थोड़ा-सा परिवर्तन है। हाइड्रोजन गैस के वातावरण में मन्द गति से गर्म करने पर ये धातुएँ हाइड्रोजन से संयोग कर लेती हैं। इन धातुओं को कार्बन के साथ गर्म करने पर कार्बाइड- Ln3C, Ln2C3 तथा LnC2 बनते हैं। ये तनु अम्लों से हाइड्रोजन गैस मुक्त करती हैं तथा हैलोजेन के वातावरण में जलने पर हैलाइड बनाती हैं। ये ऑक्साइड M2O3 तथा हाइड्रॉक्साइड M(OH)3 बनाती हैं। हाइड्रॉक्साइड निश्चित यौगिक हैं न कि केवल हाइड्रेटेड (जलयोजित) ऑक्साइड। ये क्षारीय मृदा धातुओं के ऑक्साइड तथा हाइड्रॉक्साइड की भाँति क्षारकीय होते हैं। इनकी सामान्य अभिक्रियाएँ चित्र-3 में प्रदर्शित की गई हैं।

ऐक्टिनाइड (Actinides) – ऐक्टिनाइड अत्यधिक अभिक्रियाशील धातुएँ हैं, विशेषकर जब वे सूक्ष्मविभाजित हों। इन पर उबलते हुए जल की क्रिया से ऑक्साइड तथा हाइड्राइड का मिश्रण प्राप्त होता है और अधिकांश अधातुओं से संयोजन सामान्य ताप पर होता है। हाइड्रोक्लोरिक अम्ल सभी धातुओं को प्रभावित करता है, परन्तु अधिकतर धातुएँ नाइट्रिक अम्ल द्वारा अल्प प्रभावित होती हैं, इसका कारण यह है कि इन धातुओं पर ऑक्साइड की संरक्षी सतह बन जाती है। क्षारों का इन धातुओं पर कोई प्रभाव नहीं पड़ता।
प्रश्न 21.
आप निम्नलिखित को किस प्रकार से स्पष्ट करेंगे –
- d4 स्पीशीज में से Cr2+ प्रबल अपचायक है, जबकि मैंगनीज (III) प्रबल ऑक्सीकारक है।
- जलीय विलयन में कोबाल्ट (II) स्थायी है, परन्तु संकुलनकारी अभिकर्मकों की उपस्थिति में यह सरलतापूर्वक ऑक्सीकृत हो जाता है।
- आयनों का d1 विन्यास अत्यन्त अस्थायी है।
उत्तर
- Cr2+ प्रबल ऑक्सीकारक होता है क्योंकि इसमें 3d4 से 3d3 का परिवर्तन निहित है। 3d3 विन्यास (t32g) अधिक स्थायी है। Mn3+ के ऑक्सीकारक गुणों में 3d4 से 3d5 का परिवर्तन होता है। तथा 3d5 अधिक स्थायी विन्यास है। यही कारण है कि Mn3+ प्रबल ऑक्सीकारक है।
- जटिलीकरण (complexing) अभिकर्मकों की उपस्थिति में क्रिस्टल फील्ड स्थिरीकरण ऊर्जा (CFSE) कोबाल्ट की तृतीय आयनन एन्थैल्पी से अधिक होती है। इस प्रकार Co (II) सरलता से Co (III) में ऑक्सीकृत हो जाता है।
- वे आयन जिनमें d1 विन्यास होता है, वे d-उपकक्ष में उपस्थित इलेक्ट्रॉन को त्यागने की प्रवृत्ति रखते हैं तथा अधिक स्थायी d0 विन्यास प्राप्त कर लेते हैं। यह सरलता से सम्पन्न हो सकता है। क्योंकि जलयोजन या जालक ऊर्जा का मान d-उपकक्ष से इलेक्ट्रॉन के पृथक्कीकरण में निहित आयनन एन्थैल्पी से अधिक होता है।
प्रश्न 22.
असमानुपातन से आप क्या समझते हैं? जलीय विलयन में असमानुपातन अभिक्रियाओं के दो उदाहरण दीजिए।
उत्तर
किसी रासायनिक अभिक्रिया के फलस्वरूप किसी पदार्थ का एक समय में ऑक्सीकरण व अपचयन समानुपातीकरण कहलाता है। इस प्रकार, पदार्थ की ऑक्सीकरण अवस्था बढ़ती भी है तथा घटती भी है। जैसे,

प्रश्न 23.
प्रथम संक्रमण श्रेणी में कौन-सी धातु बहुधा तथा क्यों +1 ऑक्सीकरण अवस्था दर्शाती हैं?
उत्तर
Cu(3d10 4s1) प्रायः +1 ऑक्सीकरण अवस्था प्रदर्शित करता है तथा Cu+ आयन (3d10) बनाता है, जिसकी अधिक स्थायी विन्यास होता है।
प्रश्न 24.
निम्नलिखित गैसीय आयनों में अयुग्मित इलेक्ट्रॉनों की गणना कीजिए –
Mn3+, Cr3+, v3+ तथा Ti3+
इनमें से कौन-सा जलीय विलयन में अतिस्थायी है?
उत्तर
Mn3+; 3d4 अयुग्मित इलेक्ट्रॉनों की संख्या = 4
Cr3+; 3d3 अयुग्मित इलेक्ट्रॉनों की संख्या = 3
V3+; 3d3 अयुग्मित इलेक्ट्रॉनों की संख्या = 2
Ti3+; 3d1 अयुग्मित इलेक्ट्रॉनों की संख्या = 1
इनमें से Cr3+ जलीय विलयन में अतिस्थायी हैं, क्योंकि इनमें अर्द्धपूरित t2g स्तर होता है।
प्रश्न 25.
उदाहरण देते हुए संक्रमण धातुओं के रसायन के निम्नलिखित अभिलक्षणों का कारण बताइए –
- संक्रमण धातु का निम्नतम ऑक्साइड क्षारकीय है, जबकि उच्चतम ऑक्साइड उभयधर्मी या अम्लीय है।
- संक्रमण धातु की उच्चतम ऑक्सीकरण अवस्था ऑक्साइडों तथा फ्लुओराइडों में। प्रदर्शित होती है।
- धातु के ऑक्सोऋणायनों में उच्चतम ऑक्सीकरण अवस्था प्रदर्शित होती है।
उत्तर
- निम्नतम ऑक्साइड में संक्रमण धातु की ऑक्सीकरण अवस्था सबसे कम होती है। इसलिए ऑक्साइड क्षारीय होता है तथा उच्च ऑक्सीकरण अवस्था प्राप्त करने के लिए अम्ल से क्रिया कर ऑक्सीकृत होने की प्रवृत्ति रखता है। जबकि उच्चतम ऑक्साइड उच्च ऑक्सीकरण अवस्था में बनते हैं। परिणामस्वरूप, ये ऑक्साइड अम्लीय या उभयधर्मी होते हैं।
- संक्रमण धातु की उच्चतम ऑक्सीकरण अवस्था ऑक्साइडों तथा फ्लुओराइडों में प्रदर्शित होती है। क्योंकि ऑक्सीजन तथा फ्लुओरीन उच्च विद्युत ऋणात्मक तत्त्व हैं तथा आकर में छोटे होते हैं। ये प्रबल ऑक्सीकारक होते हैं। उदाहरणार्थ– ऑस्मियम, OsF6 में +6 ऑक्सीकरण अवस्था प्रदर्शित करता है तथा वेनेडियम, V2O5 में +5 ऑक्सीकरण अवस्था प्रदर्शित करता है।
- धातु ऑक्सोऋणायनों में उच्च ऑक्सीकरण अवस्था प्रदर्शित होती है जैसे- Cr2O2-7 में Cr की ऑक्सीकरण अवस्था +6 है, जबकि MnO–4 में Mn की ऑक्सीकरण अवस्था +7 है। धातु का ऑक्सीजन से संयोग का कारण यह है कि ऑक्सीजन उच्च विद्युत ऋणात्मक तथा ऑक्सीकरक तत्त्व है।
प्रश्न 26.
निम्नलिखित को बनाने के लिए विभिन्न पदों का उल्लेख कीजिए –
- क्रोमाइट अयस्क से K2Cr2O7 (2018)
- पाइरोलुसाइट से KMnO4
उत्तर
- क्रोमाइट अयस्क से K2Cr2O7 (K2Cr2O7 from chromite ore) – अभ्यास प्रश्न 14 का उत्तर देखें।
- पाइरोलुसाइट से KMnO4(KMnO4 from pyrolusite) – अभ्यास प्रश्न 16 का (ii) देखें।
प्रश्न 27.
मिश्रातुएँ क्या हैं? लैन्थेनाइड धातुओं से युक्त एक प्रमुख मिश्रातु का उल्लेख कीजिए। इसके उपयोग भी बताइए।
उत्तर
दो या दो से अधिक धातुओं या धातुओं व अधातुओं का समांग मिश्रण मिश्रातु कहलाती है। मिश धातु एक महत्त्वपूर्ण मिश्रातु है, जिसमें 30-35% सीरियम तथा कुछ मात्रा में अन्य हल्की लैन्थेनाइड धातु Zr होती है। यह धातुकर्म में अपचायक के रूप में प्रयोग होती है। 30% मिश्रातु तथा 1% Zr धातु युक्त मैग्नीशियम मिश्रातु का प्रयोग जेट इंजन में किया जाता है।
प्रश्न 28.
आन्तरिक संक्रमण तत्व क्या हैं? बताइए कि निम्नलिखित में कौन-से परमाणु क्रमांक आन्तरिक संक्रमण तत्वों के हैं –
29, 59, 74, 95, 102, 104
उत्तर
वे तत्त्व जिनमें विभेदी इलेक्ट्रॉन (n – 2) f-उपकक्षक में प्रवेश करता है, अन्त: संक्रमण तत्त्व कहलाते हैं। दिये गये तत्त्वों में 59,95 तथा 102 परमाणु क्रमांक वाले तत्त्व अन्त: संक्रमण तत्त्व हैं।
प्रश्न 29.
ऐक्टिनाइड तत्वों का रसायन उतना नियमित नहीं है जितना कि लैन्थेनाइड तत्वों का रसायन। इन तत्वों की ऑक्सीकरण अवस्थाओं के आधार पर इस कथन का आधार प्रस्तुत कीजिए।
उत्तर
लैन्थेनाइडों की ऑक्सीकरण अवस्थाएँ +2, +3 तथा +4 हैं। इनमें से +3 अवस्था सर्वाधिक सामान्य है। ऑक्सीकरण अवस्थाओं की सीमित संख्या का कारण 4f, 5d तथा 6s उपकक्षाओं के बीच अधिक ऊर्जा अन्तर होना है। इसके विपरीत, ऐक्टिनाइड अनेक ऑक्सीकरण अवस्थाएँ जैसे +2, +3, +4, +5, +6 तथा +7 प्रदर्शित करते हैं, यद्यपि इनकी सामान्य अवस्था +3 होती है। इसका कारण यह है कि 5f, 6d तथा 7s उपकक्षाओं के बीच ऊर्जा का अन्तर कम होता है।
प्रश्न 30.
ऐक्टिनाइड श्रेणी का अन्तिम तत्व कौन-सा है? इस तत्व का इलेक्ट्रॉनिक विन्यास लिखिए। इस तत्व की सम्भावित ऑक्सीकरण अवस्थाओं पर टिप्पणी कीजिए।
उत्तर
ऐक्टिनाइड श्रेणी का अन्तिम तत्त्व लॉरेन्शियम (Lr) है तथा इसका परमाणु क्रमांक 103 होता है। इसका इलेक्ट्रॉनिक विन्यास [Rn]5f14 6d1 7s2 है तथा सम्भावित ऑक्सीकरण अवस्था +3 है।
प्रश्न 31.
हुण्ड-नियम के आधार पर Ce3+ आयन के इलेक्ट्रॉनिक विन्यास को व्युत्पन्न कीजिए तथा ‘प्रचक्रण मात्र सूत्र के आधार पर इसके चुम्बकीय आघूर्ण की गणना कीजिए।
उत्तर
Ce तथा Ce3+ आयन का इलेक्ट्रॉनिक विन्यास निम्न है –
Ce (Z = 58) : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
4d10 4f1 5s2 5p6 5d1 6s2 या : [Xe] 4f1 5d1 6s2
Ce3+ (z = 55) : [Xe]4f1
इस प्रकार Ce+ में केवल एक अयुग्मित इलेक्ट्रॉन होता है, अर्थात् n = 1
∴ μs = BM
=
= 1.732 BM
प्रश्न 32.
लैन्थेनाइड श्रेणी के उन सभी तत्वों का उल्लेख कीजिए जो +4 तथा जो +2 ऑक्सीकरण अवस्थाएँ दर्शाते हैं। इस प्रकार के व्यवहार तथा उनके इलेक्ट्रॉनिक विन्यास के बीच सम्बन्ध स्थापित कीजिए। उत्तर
+4 ऑक्सीकरण अवस्था : Ce, Pr, Nd, Tb तथा Dy
+2 ऑक्सीकरण अवस्था : Ce, Nd, Sm, Tm तथा Yb
ये तत्त्व +2 ऑक्सीकरण अवस्था उस समय प्रदर्शित करते हैं जब इनका इलेक्ट्रॉनिक विन्यास 5d0 6s2 होता है। इसके विपरीत, +4 अवस्था उस समय प्रदर्शित की जाती है जब इनका शेष विन्यास 4f0 के समीप (जैसे 4f1, 4f2, 4f3) या 4f7 की समीप (जैसे 4f8, 4f9) होता है।
प्रश्न 33.
निम्नलिखित के सन्दर्भ में ऐक्टिनाइड श्रेणी के तत्वों तथा लैन्थेनाइड श्रेणी के तत्वों के रसायन की तुलना कीजिए –
(i) इलेक्ट्रॉनिक विन्यास
(ii) ऑक्सीकरण अवस्थाएँ।
(iii) रासायनिक अभिक्रियाशीलता।
उत्तर
1. इलेक्ट्रॉनिक विन्यास (Electronic configuration) – लैन्थेनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Xe]54 4f1-14 5d0-1 6s2 होता है, जबकि ऐक्टिनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Rn]86 5f1-14 6d1-2 7s2 होता है। अतः लैन्थेनाइड 4f श्रेणी से तथा ऐक्टिनाइड 5f श्रेणी से सम्बद्ध होते हैं।
2. ऑक्सीकरण अवस्था (Oxidation states) – लैन्थेनाइड सीमित ऑक्सीकरण अवस्थाएँ (+2, + 3, +4) प्रदर्शित करते हैं जिनमें +3 ऑक्सीकरण अवस्था सबसे अधिक सामान्य है। इसका कारण 4f, 5d तथा 6s उपकोशों के बीच अधिक ऊर्जा-अन्तर होना है। दूसरी ओर ऐक्टिंनाइड अधिक संख्या में ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं क्योंकि 5f,6d तथा 7s उपकोशों में ऊर्जा-अन्तर कम होता है।
3. रासायनिक अभिक्रियाशीलता (Chemical reactivity) – लैन्थेनाइड (Lanthanides) सामान्य रूप से श्रेणी के आरम्भ वाले सदस्य अपने रासायनिक व्यवहार में कैल्सियम की तरह बहुत क्रियाशील होते हैं, परन्तु बढ़ते परमाणु क्रमांक के साथ ये ऐलुमिनियम की तरह व्यवहार करते हैं।
अर्द्ध- अभिक्रिया Ln3+ (aq) + 3e– → Ln(s) के लिए E– का मान -2.2 V से -2.4 V के परास में है। Eu के लिए E– का मान -2.0 V है। निस्सन्देह मान में थोड़ा-सा परिवर्तन है। हाइड्रोजन गैस के वातावरण में मन्द गति से गर्म करने पर ये धातुएँ हाइड्रोजन से संयोग कर लेती हैं। इन धातुओं को कार्बन के साथ गर्म करने पर कार्बाइड- Ln3C, Ln2C3 तथा LnC2 बनते हैं। ये तनु अम्लों से हाइड्रोजन गैस मुक्त करती हैं तथा हैलोजेन के वातावरण में जलने पर हैलाइड बनाती हैं। ये ऑक्साइड M2O3 तथा हाइड्रॉक्साइड M(OH)3 बनाती हैं। हाइड्रॉक्साइड निश्चित यौगिक हैं न कि केवल हाइड्रेटेड (जलयोजित) ऑक्साइड। ये क्षारीय मृदा धातुओं के ऑक्साइड तथा हाइड्रॉक्साइड की भाँति क्षारकीय होते हैं। इनकी सामान्य अभिक्रियाएँ चित्र-3 में प्रदर्शित की गई हैं।
ऐक्टिनाइड (Actinides) – ऐक्टिनाइड अत्यधिक अभिक्रियाशील धातुएँ हैं, विशेषकर जब वे सूक्ष्मविभाजित हों। इन पर उबलते हुए जल की क्रिया से ऑक्साइड तथा हाइड्राइड का मिश्रण प्राप्त होता है और अधिकांश अधातुओं से संयोजन सामान्य ताप पर होता है। हाइड्रोक्लोरिक अम्ल सभी धातुओं को प्रभावित करता है, परन्तु अधिकतर धातुएँ नाइट्रिक अम्ल द्वारा अल्प प्रभावित होती हैं, इसका कारण यह है कि इन धातुओं पर ऑक्साइड की संरक्षी सतह बन जाती है। क्षारों का इन धातुओं पर कोई प्रभाव नहीं पड़ता।
प्रश्न 34.
61, 91, 101 तथा 109 परमाणु क्रमांक वाले तत्वों का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर
Z = 61 (प्रोमिथियम, Pr) का इलेक्ट्रॉनिक विन्यास,
[Xe]54 4f5 5d0 6s2
Z = 91 (प्रोटेक्टिनियम, Pa) का इलेक्ट्रॉनिक विन्यास,
[Rn]86 5f2 6d1 7s2
Z = 101 (मेण्डेलीवियम, Md) का इलेक्ट्रॉनिक विन्यास
[Rn]86 5f13 6d0 7s2
Z = 109 (मेटनेरियम, Mt) का इलेक्ट्रॉनिक विन्यास
[Rn]86 5f14 6d7 7s2
प्रश्न 35.
प्रथम श्रेणी के संक्रमण तत्वों के अभिलक्षणों की द्वितीय एवं तृतीय श्रेणी के वर्गों के संगत तत्वों से क्षैतिज वर्गों में तुलना कीजिए। निम्नलिखित बिन्दुओं पर विशेष महत्त्व दीजिए –
- इलेक्ट्रॉनिक विन्यास
- ऑक्सीकरण अवस्थाएँ
- आयनन एन्थैल्पी तथा
- परमाण्वीय आकार।
उत्तर
1. इलेक्ट्रॉनिक विन्यास (Electronic configuration) – एक ही वर्ग के तत्वों के इलेक्ट्रॉनिक विन्यास सामान्यतया समान होते हैं। यद्यपि प्रथम संक्रमण श्रेणी दो अपवाद प्रदर्शित करती है –
Cr = 3d5 4s1 तथा Cu = 3d10 4s1, परन्तु द्वितीय श्रेणी इससे अधिक अपवाद प्रदर्शित करती है –
Mo (42) = 4d5 5s1, Tc (43) = 4d6 5s1, Ru (44) = 4d7 5s1, Rh (45) = 4d8 5s1, Pd (46) = 4d210 5s0, Ag (47) = 4d10 5s1। इसी प्रकार, तृतीय श्रेणी में W (74) = 5d4 6s1, Pt (78) = 5d9 6s1 तथा Au (79) = 5d10 6s1 अपवाद हैं। इसलिए क्षैतिज वर्ग में अनेक स्थितियों में, तीनों श्रेणियों के इलेक्ट्रॉनिक विन्यास समान नहीं हैं।
2. ऑक्सीकरण अवस्थाएँ (Oxidation states) – समान क्षैतिज वर्ग में तत्व सामान्यतया समान ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं। प्रत्येक श्रेणी के मध्य में तत्वों द्वारा प्रदर्शित ऑक्सीकरण अवस्थाओं की संख्या अधिकतम होती है, जबकि अन्त में न्यूनतम होती है।
3. आयनन एन्थैल्पी (Ionization enthalpy) – प्रत्येक श्रेणी में बाएँ से दाएँ जाने पर प्रथम आयनन एन्थैल्पी सामान्यतया धीरे-धीरे बढ़ती है, यद्यपि प्रत्येक श्रेणी में कुछ अपवाद भी प्रेक्षित होते हैं। समान क्षैतिज वर्ग में 3d श्रेणी के तत्वों की तुलना में 4d श्रेणी के कुछ तत्वों की प्रथम आयनन एन्थैल्पी उच्च तथा कुछ तत्वों की कम होती है, यद्यपि 5d श्रेणी की प्रथम आयनन एन्थैल्पी 3d तथा 4d श्रेणियों की तुलना में उच्च होती है। इसका कारण 5d श्रेणी में 4f इलेक्ट्रॉनों पर नाभिक का दुर्बल परिरक्षण प्रभाव है।
4. परमाण्वीय आकार (Atomic sizes) – सामान्यतया किसी श्रेणी में समान आवेश के आयन अथवा परमाणु, परमाणु क्रमांक बढ़ने के साथ त्रिज्याओं में क्रमिक कमी प्रदर्शित करते हैं, यद्यपि यह कमी अत्यन्त कम होती है। परन्तु 4d श्रेणी के परमाणुओं के आकार, 3d श्रेणी के सम्बन्धित तत्वों की तुलना में अधिक होते हैं, जबकि 5d श्रेणी के सम्बन्धित तत्वों के आकार के लगभग समान होते हैं। इसका कारण लैन्थेनाइड आकुंचन है।
प्रश्न 36.
निम्नलिखित आयनों में प्रत्येक के लिए 3d इलेक्ट्रॉनों की संख्या लिखिए –
Ti2+, V2+, Cr3+, Mn2+, Fe2+, Fe3+, Co2+, Ni2+, Cu2+
आप इन जलयोजित आयनों (अष्टफलकीय) में पाँच 3d कक्षकों को किस प्रकार अधिग्रहीत करेंगे? दर्शाइए।
उत्तर



प्रश्न 37.
प्रथम संक्रमण श्रेणी के तत्व भारी संक्रमण तत्वों के अनेक गुणों से भिन्नता प्रदर्शित करते हैं। टिप्पणी कीजिए।
उत्तर
दिया गया कथन सत्य है। इस कथन के पक्ष में कुछ प्रमाण निम्नलिखित हैं –
- भारी संक्रमण तत्वों (4d तथा 5d श्रेणियाँ) की परमाणु त्रिज्याएँ प्रथम संक्रमण श्रेणी के सम्बन्धित तत्वों की तुलना में अधिक होती हैं, यद्यपि 4d तथा 5d श्रेणियों की परमाणु त्रिज्याएँ लगभग समान होती हैं।
- 5d श्रेणी की आयनन एन्थैल्पियाँ 3d तथा 4d श्रेणियों के सम्बन्धित तत्वों से उच्च होती हैं।
- 4d तथा 5d श्रेणियों की कणन एन्थैल्पियाँ प्रथम श्रेणी के सम्बन्धित तत्वों की तुलना में उच्च होती हैं।
- भारी संक्रमण तत्वों के गलनांक तथा क्वथनांक प्रथम संक्रमण श्रेणी की तुलना में अधिक होते हैं। इसका कारण इनमें प्रबल अन्तराधात्विक बन्धों की उपस्थिति है।
प्रश्न 38.
निम्नलिखित संकुल स्पीशीज के चुम्बकीय आघूर्णो के मान से आप क्या निष्कर्ष निकालेंगे?

उत्तर
यदि किसी जटिल यौगिक में ‘n’ अयुग्मित इलेक्ट्रॉन होते हैं, तो इसका चक्रण के कारण चुम्बकीय आघूर्ण निम्न प्रकार प्राप्त किया जा सकता है –
μs = BM
∴ जब n = 1, μs = = 1.73 BM
n = 2, μs = = 2.83 BM
n = 3, μs = = 3.87 BM
n = 4, μs = = 4.9 BM
n = 5, μs = = 5.92 BM
(i) K4[Mn(CN)6] का चुम्बकीय आघूर्ण 2.2 BM है। इससे स्पष्ट है कि इसमें केवल एक अयुग्मित इलेक्ट्रॉन है। इस जटिल यौगिक में Mn की ऑक्सीकरण अवस्था +2 है। अतएव यह Mn2+ के रूप में है। Mn2+ का अभिविन्यास 3d होता है। एक अयुग्मित इलेक्ट्रॉन की उपस्थिति स्पष्ट करती है कि CN– लीगैण्ड ने निम्नानुसार इलेक्ट्रॉनों को हुण्ड के नियम के विपरीत युग्मित कर दिया है –
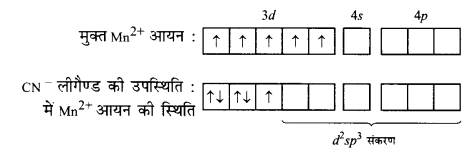
इस प्रकार यह निष्कर्ष निकाला जा सकता है कि CN– एक प्रबल लीगैण्ड है तथा जटिल यौगिक के बनने में d2 sp3 संकरण होता है। अत: जटिल यौगिक एक आन्तरिक ऑर्बिटल अष्टफलकीय जटिल यौगिक है।
(ii) [Fe(H2O)6]2+ का चुम्बकीय आघूर्ण 5.3 है। इससे स्पष्ट है कि इसमें 4 अयुग्मित इलेक्ट्रॉन हैं। इसमें Fe की ऑक्सीकरण अवस्था +2 है। इस प्रकार यह Fe2+ आयन के रूप में है, जिसको अभिविन्यास 3d6 है। यौगिक में 4 अयुग्मित इलेक्ट्रॉन की उपस्थिति सिद्ध करती है कि H2O लीगैण्ड दुर्बल है तथा इलेक्ट्रॉनों को युग्मित करने में असमर्थ है।
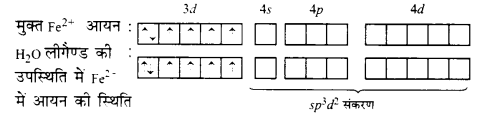
इस प्रकार, यह निष्कर्ष निकलता है कि H2O एक दुर्बल लीगण्ड है तथा इसमें sp3 d2 संकरण होता है। यह एक बाह्य ऑर्बिटल अष्टफलकीय जटिल यौगिक है।
(iii) K2[MnCl4] का चुम्बकीय आघूर्ण 5.9 है, जिससे स्पष्ट है कि इसमें 5 अयुग्मित इलेक्ट्रॉन हैं। Mn की ऑक्सीकरण अवस्था +2 है। अत: यह Mn2+ अवस्था में है तथा इसका विन्यास 3d5 है। 5 अयुग्मित इलेक्ट्रॉनों की उपस्थिति से स्पष्ट है कि Cl– दुर्बल लीगैण्ड है तथा इलेक्ट्रॉन का युग्मन करने में असमर्थ है।

इस प्रकार यह निष्कर्ष निकलता है कि Cl– एक दुर्बल लीगैण्ड है तथा जटिल यौगिक में sp3 संकरण है। अतएव यह एक समचतुष्फलकीय जटिल यौगिक है।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
संक्रमण श्रेणी धातुओं का विशिष्ट गुण है –
(i) ये परिवर्ती ऑक्सीकरण अवस्था प्रदर्शित करती हैं।
(ii) ये सभी धातु उत्प्रेरक का कार्य करती हैं।
(iii) ये रंगीन यौगिक बनाती हैं।
(iv) उपर्युक्त सभी
उत्तर
(iv) उपर्युक्त सभी
प्रश्न 2.
संक्रमण तत्त्व संकुल यौगिक बनाते हैं क्योंकि –
(i) रिक्त कक्षकों की उपलब्धता होती है।
(ii) धातु आयनों का आकार छोटा होता है।
(iii) परिवर्तनीय ऑक्सीकरण अवस्था होती है।
(iv) उपर्युक्त सभी
उत्तर
(iv) उपर्युक्त सभी
प्रश्न 3.
संक्रमण तत्वों में 4d श्रेणी का तत्त्व है – (2015)
(i) 37A
(ii) 47B
(iii) 57C
(iv) 30D
उत्तर
(ii) 47B
प्रश्न 4.
कौन-सा तत्त्व d-ब्लॉक तत्त्व तो है किन्तु संक्रमण धातु नहीं है?
(i) Zn
(ii) Cu
(iii) Cr
(iv) Mn
उत्तर
(i) Zn
प्रश्न 5.
निम्नलिखित में अनुचुम्बकीय यौगिक है – (2017)
(i) CuCl
(ii) AgNO3
(iii) FeSO4
(iv) ZnCl2
उत्तर
(iii) FeSO4
प्रश्न 6.
निम्नलिखित आयनों में अनुचुम्बकीय आयन कौन-सा नहीं है? (2013)
(Ni= 28, Zn= 30, Cu= 29, Mn= 25)
(i) Ni++
(ii) Zn++
(iii) Cu+
(iv) Mn++
उत्तर
(ii) Zn++
प्रश्न 7.
निम्न में अनुचुम्बकीय आयन है। (2013, 16)
(i) Zn2+
(ii) Ni2+
(iii) Cu+
(iv) Ag+
उत्तर
(ii) Ni2+
प्रश्न 8.
निम्न में से रंगहीन आयन है। (2013)
(i) Cu+
(ii) Cu2+
(iii) Ni2+
(iv) Fe3+
उत्तर
(i) Cu+
प्रश्न 9.
एक संक्रमण धातु की अधिकतम ऑक्सीकरण अवस्था प्राप्त करने में कौन-से इलेक्ट्रॉन मुक्त होते हैं? (2018)
(i) ns इलेक्ट्रॉन
(ii) (n + 1) d इलेक्ट्रॉन
(iii) (n – 1)d इलेक्ट्रॉन
(iv) ns + (n – 1) d इलेक्ट्रॉन
उत्तर
(iv) ns + (n – 1) d इलेक्ट्रॉन
प्रश्न 10.
संक्रमण धातु जो परिवर्ती ऑक्सीकरण अवस्था नहीं प्रदर्शित करता है, है (2014)
(i) Ti
(ii) V
(iii) Fe
(iv) Zn
उत्तर
(iv) Zn
प्रश्न 11.
दुर्लभ मृदा तत्त्व हैं –
(i) क्षारीय मृदा तत्त्व
(ii) क्षारीय तत्त्व
(iii) संक्रमण श्रेणी के तत्त्व
(iv) लैन्थेनाइड
उत्तर
(iv) लैन्थेनाइड
प्रश्न 12.
निम्न तत्त्वों में लैन्थेनाइड तत्त्व है – (2015)
(i) Ra
(ii) Ce
(iii) Ac
(iv) Zr
उत्तर
(ii) Ce
प्रश्न 13.
लैन्थेनाइडों का सामान्य बाह्यतम इलेक्ट्रॉनिक विन्यास है –
(i) 4f1-14 5d0 6s2
(ii) 4f0,2-14 5d0 6s2
(iii) 4f20-14 5d0-2 6s2
(iv) 4f0-14 5d1 6s2
उत्तर
(ii) 4f0,2-14 5d0 6s2
प्रश्न 14.
लैन्थेनाइड निम्न ऋणायन के साथ संकुल बनाते हैं।
(i) F–
(ii) Br–
(iii) Cl–
(iv) इनमें से कोई नहीं
उत्तर
(i) F–
प्रश्न 15.
लैन्थेनाइडों के परमाणु क्रमांक के बढ़ने के साथ परमाणवीय त्रिज्या में कमी होती है, किन्तु अपवाद है।
(i) Gd व Lu
(ii) Eu व Yb
(iii) Na व Ho
(iv) Dy व Ho
उत्तर
(ii) Eu व Yb
प्रश्न 16.
लैन्थेनाइड संकुचन के कारण पश्च लैन्थेनाइडों में
(i) आयनन ऊर्जा अधिक हो जाती है।
(ii) घनत्व उच्च हो जाता है।
(iii) आयनिक त्रिज्या कम हो जाती है।
(iv) ये सभी
उत्तर
(iv) ये सभी
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
संक्रमण तत्त्वों की परमाणु त्रिज्याएँ किसी श्रेणी में किस प्रकार परिवर्तित होती हैं? (2014)
उत्तर
सामान्यत: एक विशिष्ट श्रेणी से सम्बन्धित संक्रमण तत्त्वों की परमाणु त्रिज्याएँ परमाणु क्रमांक के बढ़ने के साथ घटती जाती हैं। प्रत्येक श्रेणी के अन्त में परमाणु त्रिज्याओं में थोड़ी वृद्धि देखने को मिलती है। समूह में नीचे की ओर जाने पर संक्रमण तत्त्वों की परमाणु त्रिज्याओं में वृद्धि होती है। द्वितीय और तृतीय संक्रमण श्रेणी के तत्त्वों की परमाणु त्रिज्याएँ लगभग समान रहती हैं।
प्रश्न 2.
संक्रमण तत्त्व धात्विक लक्षण क्यों प्रदर्शित करते हैं? (2014)
उत्तर
संक्रमण तत्त्व धात्विक लक्षण प्रदर्शित करते हैं क्योंकि उनकी आयनन ऊर्जाएँ निम्न होती हैं तथा । उनके बाह्यतम कोश में अनेक रिक्त कक्षक भी उपस्थित होते हैं। ये कारक उनमें धात्विक आबन्धों के निर्माण में सहायता करते हैं।
प्रश्न 3.
विलयन में Cu’ आयन रंगहीन जबकि Cu2+ आयन रंगीन होते हैं। क्यों? (2017)
उत्तर
Cu+ – 1s2, 252, 2p6, 3s2, 3p6, 3d10, 4s0, चूंकि सभी इलेक्ट्रॉन युग्मित हैं इसलिए Cu+ आयन रंगहीन है। Cu2+ आयन में एक अयुग्मित इलेक्ट्रॉन है इसलिए यह नीले रंग का है।
Cu2+ – 1s2, 2s2, 2p6, 3s2, 3p6, 3d9

प्रश्न 4.
Mn3+ आयन की अपेक्षा Mn2+ आयन अधिक स्थायी होते हैं। क्यों? (2017)
उत्तर
हम जानते हैं कि आधे और पूरे भरे हुए ऑर्बिटल अधिक स्थायी होते हैं। Mn2+ में 3d पर पाँच इलेक्ट्रॉन हैं जोकि आधा भरा हुआ है। इसलिए Mn3+ आयन की अपेक्षा Mn2+ आयन अधिक स्थायी होते हैं।

प्रश्न 5.
आयतनात्मक विश्लेषण में पोटैशियम परमैंगनेट विलयन को अम्लीकृत करने के लिए तनु सल्फ्यूरिक अम्ल के स्थान पर HNO3 का प्रयोग क्यों नहीं किया जाता है? (2015)
उत्तर
आयतनात्मक विश्लेषण में KMnO4 विलयन को अम्लीकृत करने के लिए dil. H2SO4 का प्रयोग किया जाता है न कि HNO3 का क्योकि HNO3 स्वयं ऑक्सीकारक है और आंशिक रूप से अपचायक को ऑक्सीकृत कर देता है।
2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 3H2O + 5[O]
Reducing agent + [O] → Oxidised product
प्रश्न 6.
आन्तरिक (अन्तः) संक्रमण तत्त्व क्या हैं? (2014)
उत्तर
जिन तत्त्वों में विभेदी इलेक्ट्रॉन (n- 2) f- कक्षकों में प्रवेश करता है वे तत्त्व आन्तरिक (अन्तः) संक्रमण तत्त्व कहलाते हैं। ये तत्त्व आवर्त सारणी में एक अलग ब्लॉक, f-ब्लॉक का निर्माण करते हैं; अत: इन्हें f- ब्लॉक के तत्त्व भी कहते हैं।
प्रश्न 7.
लैन्थेनाइड व ऐक्टिनाइड श्रेणियों का सामान्य इलेक्ट्रॉनिक विन्यास लिखिए। या अन्तः संक्रमण तत्त्वों के सामान्य इलेक्ट्रॉनिक विन्यास लिखिए। (2014)
उत्तर
लैन्थेनाइड्स के इलेक्ट्रॉनिक विन्यास निश्चित रूप से ज्ञात नहीं हैं। अधिकांश तत्त्वों में विभेदी इलेक्ट्रॉन 4f- उपकोश में प्रवेश करता है; अतः इन तत्त्वों का सैद्धान्तिक इलेक्ट्रॉनिक विन्यास [Xe] 4fn 5d1 6s2 प्रकार का होता है।
चूँकि 4f- उपकोश की ऊर्जा 5d-उपकोश की ऊर्जा के काफी निकट है; अत: यह विभेद करना कठिन होता है कि इलेक्ट्रॉन 4f उपकोश में प्रवेश कर रहा है अथवा 5d-उपकोश में। यही कारण है कि इनके प्रागुक्त इलेक्ट्रॉनिक विन्यास, इनके अवलोकित विन्यासों से भिन्न होते हैं। अवलोकित विन्यास मुख्यत: [Xe] 4fn+1 6s2 प्रकार के होते हैं।
ऐक्टिनाइड्स के इलेक्ट्रॉनिक विन्यासों को [Rn] 5f1-14 6d0-1 7s2 (अपवाद थोरियम को छोड़कर) के रूप में प्रकट किया जा सकता है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
संक्रमण तत्त्व क्या हैं? इनकी विशेषताओं को लिखिए। (2014, 16, 17)
या
संक्रमण तत्त्वों के अनुचुम्बकीय लक्षण को स्पष्ट कीजिए। (2018)
उत्तर
वे तत्त्व जिनमें अन्तिम इलेक्ट्रॉन बाह्य कोश से पहले वाले कोश के पाँच d-कक्षकों में से किसी भी एक कक्ष में प्रवेश करता है, d-ब्लॉक के तत्त्व कहलाते हैं। इनमें विभेदी इलेक्ट्रॉन (n-1) d-कक्षकों में प्रवेश पाता है। चूँकि इन तत्त्वों के गुण s-ब्लॉक तथा p-ब्लॉक के तत्त्वों के गुणों के मध्यवर्ती होते हैं अत: इन्हें संक्रमण तत्त्व भी कहते हैं।
विशेषताएँ– संक्रमण तत्त्वों की विशेषताएँ निम्नलिखित हैं –
1. इलेक्ट्रॉनिक विन्यास – संक्रमण तत्त्वों में बाह्यकोश से पिछले कोश के d ऑर्बिटलों में इलेक्ट्रॉन भरते हैं। इसके बाह्यतम दो कोशों का विन्यास इस प्रकार होता है –
(n – 1)s2 (n – 1)p6 (n-1)d1 to 10 ns1 or 2 या ns0
2. परिवर्ती ऑक्सीकरण अवस्थाएँ – d-ब्लॉक (संक्रमण) तत्त्वों में ns ऑर्बिटल और (n – 1)d ऑर्बिटल दोनों के इलेक्ट्रॉन रासायनिक बन्ध बनाने में भाग लेते हैं। इसलिए संक्रमण तत्त्व परिवर्ती ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
संक्रमण तत्त्वों में (n – 1)d और ns ऊर्जा स्तरों की ऊर्जा में थोड़ा अन्तर होने के कारण ये इलेक्ट्रॉन रासायनिक बन्ध बनाने में भाग ले सकते हैं। इसलिए संक्रमण तत्त्व परिवर्ती ऑक्सीकरण संख्या प्रदर्शित करते हैं।
3. उत्प्रेरक गुण – संक्रमण धातु और उनके यौगिकों में उत्प्रेरकीय गुण होते हैं। यह गुण उनकी परिवर्ती संयोजकता एवं उनके पृष्ठ पर उपस्थित मुक्त संयोजकताओं के कारण होता है।
4. रंगीन आयन व रंगीन यौगिक बनाने की प्रवृत्ति – संक्रमण तत्त्वों में d ऑर्बिटल आंशिक रूप से भरे होने के कारण ये रंगीन आयन व रंगीन यौगिक बनाते हैं।
5. आयनन विभव में परिवर्तन – संक्रमण धातुओं के प्रथम आयनन विभव दीर्घ आवर्गों में स्थित s-ब्लॉक और p ब्लॉक तत्त्वों के आयनन विभवों के बीच के हैं। प्रथम संक्रमण श्रेणी में तत्त्वों के प्रथम आयनन विभवों के मान 6 से 10 eV के मध्य है। किसी संक्रमण धातु परमाणु के उत्तरोत्तर (successive) आयनन विभव कम से बढ़ते हैं। संक्रमण धातु क्षार धातुओं (उपवर्ग IA) और क्षारीय मृदा-धातुओं (उपवर्ग IIA) से कम धन विद्युत होने के कारण आयनिक और सहसंयोजक दोनों प्रकार के यौगिक बनाते हैं।
6. चुम्बकीय लक्षण – अनेक संक्रमण तत्त्व उनके यौगिक अनुचुम्बकीय हैं। इसका कारण उनमें (n – 1) d कक्षकों में अयुग्मित इलेक्ट्रॉनों की उपस्थिति है। किसी संक्रमण श्रेणी में बायें से दायें जाने पर जैसे-जैसे अयुग्मि इलेक्ट्रॉनों की संख्या एक से पाँच तक बढ़ती है, संक्रमण धातु आयन में अनुचुम्बकीय लक्षण बढ़ता है। अधिकतम अनुचुम्बकीय लक्षण श्रेणी के बीच में पाया जाता है और आगे जाने पर अनुचुम्बकीय लक्षण अयुग्मित इलेक्ट्रॉनों की संख्या कम होने से घटता है। वे संक्रमण धातु अथवा आयन जिनमें इलेक्ट्रॉन युग्मित होते हैं, प्रतिचुम्बकीय होते हैं।
प्रश्न 2.
संक्रमण तत्त्व परिवर्ती ऑक्सीकरण अवस्था का प्रदर्शन क्यों करते हैं? (2015)
उत्तर
संक्रमण तत्त्वों का सामान्य इलेक्ट्रॉनिक विन्यास (n – 1)d1 – 10 ns1 – 2 है। (n – 1) d-कक्षकों तथा ns- कक्षकों की ऊर्जाओं में अधिक अन्तर नहीं होता है अत: संक्रमण तत्त्वों में, (n – 1)d तथा ns दोनों कक्षकों के आबन्ध निर्माण के लिए उपलब्ध रहती हैं। +1 तथा +2 ऑक्सीकरण अवस्थाओं में ns-इलेक्ट्रॉनों का योगदान होता है, जबकि उच्च ऑक्सीकरण अवस्थाओं जैसे +3, +4,+ 5,+6 आदि, में आबन्ध निर्माण में ns-कक्षकों के साथ (n – 1)d-इलेक्ट्रॉनों का भी योगदान होता है। उत्तेजित अवस्था में (n – 1) d. इलेक्ट्रॉन आबन्ध निर्माण में भाग लेने के लिए स्वतन्त्र हो जाते हैं तथा परमाणु विभिन्न ऑक्सीकरण अवस्थाएँ प्रदर्शित करने के योग्य हो जाता है। उदाहरण के लिए, Sc का बाह्य इलेक्ट्रॉनिक विन्यास 3d1 4s2 है। जब यह केवल 4s-इलेक्ट्रॉनों का उपयोग करता है तो +2 ऑक्सीकरण अवस्था प्रदर्शित करता है, परन्तु जब यह दोनों 4s- इलेक्ट्रॉनों के साथ एक 3d-इलेक्ट्रॉन का भी उपयोग करता है तो +3 ऑक्सीकरण अवस्था प्रदर्शित करता है।
प्रश्न 3.
संक्रमण तत्त्वों में जटिल यौगिक बनाने की प्रवृत्ति अधिक क्यों होती है? (2017)
उत्तर
संक्रमण तत्त्वों में जटिल यौगिक बनाने की प्रवृत्ति निम्नलिखित कारणों से अधिक होती है –
- धातु आयनों का छोटा आकार
- धातु आयनों का उच्च नाभिकीय आवेश
- लीगैण्ड द्वारा प्रदान किये गये इलेक्ट्रॉनों के एकाकी युग्मों को ग्रहण करने के लिए उपयुक्त ऊर्जा के रिक्त d-कक्षकों की प्राप्यता।
प्रश्न 4.
ऐक्टिनाइड्स व लैन्थेनाइड्स में मुख्य समानताएँ बताइए। (2015)
उत्तर
चूंकि लैन्थेनाइड्स तथा ऐक्टिनाइड्स दोनों में ही इलेक्ट्रॉन (n- 2) f-उपकोश में प्रवेश पाता है। तथा दोनों के ही बाह्य इलेक्ट्रॉनिक विन्यास लगभग समान हैं, अतः ये गुणों में समानताएँ प्रदर्शित करते हैं। इनकी मुख्य समानताएँ निम्नलिखित हैं –
- दोनों में ही (n – 2) f- कक्षक में इलेक्ट्रॉन प्रवेश करता है।
- दोनों की प्रमुख ऑक्सीकरण अवस्था +3 है।
- परमाणु क्रमांक बढ़ने पर दोनों ही परमाणविक तथा आयनिक आकारों में कमी प्रदर्शित करते हैं (लैन्थेनाइड संकुचन तथा ऐक्टिनाइड संकुचन)।
- दोनों ही अधिक क्रियाशील तथा प्रबल विद्युत धनात्मक हैं।
- दोनों ही चुम्बकीय गुण प्रदर्शित करते हैं।
प्रश्न 5.
लैन्थेनाइड्स व ऐक्टिनाइड्स में अन्तर/ असमानताएँ बताइए। (2014)
उत्तर
लैन्थेनाइड्स व ऐक्टिनाइड्स में निम्नलिखित अन्तर/असमानताएँ हैं –

प्रश्न 6.
ऐक्टिनाइड्स क्या हैं? इन्हें ऐक्टिनाइड्स क्यों कहा जाता है? इनके प्रमुख उपयोग लिखिए। (2016)
उत्तर
आन्तरिक संक्रमण तत्त्व अथवा f-ब्लॉक तत्त्वों की दो श्रेणियाँ होती हैं –
- लैन्थेनाइड श्रेणी तथा
- ऐक्टिनाइड श्रेणी।
ऐक्टिनाइड श्रेणी में थोरियम से लेकर लॉरेन्शियम तक के चौदह तत्त्वों को ऐक्टिनाइड्स कहा जाता है। ये तत्त्व आवर्त सारणी में ऐक्टिनियम का अनुसरण करते हैं तथा भौतिक व रासायनिक गुणों में उससे समानता भी प्रकट करते हैं। इसलिए इन्हें ऐक्टिनाइड्स कहा जाता है।
ऐक्टिनाइडों के उपयोग
- यूरेनियम तथा प्लूटोनियम का मुख्य उपयोग नाभिकीय रिएक्टर से परमाणु ऊर्जा उत्पादन में ईंधन के रूप में किया जाता है। प्लूटोनियम का उपयोग परमाणु हथियार बनाने में भी किया जाता है।
- थोरियम ऑक्साइड का उपयोग चमकने वाले गैस मेन्टल के निर्माण में होता है।
- यूरेनियम के लवणों का उपयोग हरे रंग के काँच के निर्माण में होता है।
- थोरियम लवण का उपयोग आजकल कैंसर के उपचार में होता है।
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
संक्रमण तत्त्वों को वर्गीकृत कीजिए तथा आवर्त सारणी में इनका स्थान निर्धारित कीजिए।
उत्तर
संक्रमण तत्त्वों का वर्गीकरण – संक्रमण तत्त्वों का वर्गीकरण (n – 1)d- कक्षकों के आधार पर किया गया है। इस आधार पर संक्रमण तत्त्वों को चार श्रेणियों में विभाजित किया गया है जिन्हें संक्रमण श्रेणियाँ (transition series) कहते हैं। प्रत्येक श्रेणी (n – 1)d- कक्षक में इलेक्ट्रॉन-प्रवेश के क्रम के अनुसार है। ये संक्रमण श्रेणियाँ निम्नलिखित हैं –
- प्रथम संक्रमण श्रेणी अथवा 3d- श्रेणी – इस श्रेणी में इलेक्ट्रॉन 3d- कक्षक में प्रवेश पाता है। इस श्रेणी में Sc (Z = 21) से Zn (Z = 30) तक 10 तत्त्व हैं। ये तत्त्व आवर्त सारणी के चतुर्थ आवर्त में स्थित हैं।
- द्वितीय संक्रमण श्रेणी अथवा 4d- श्रेणी – इस श्रेणी में इलेक्ट्रॉन 4d- कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व Y(Z = 39) से Cd (Z = 48) हैं। ये तत्त्व आवर्त सारणी के पाँचवे आवर्त में स्थित हैं।
- तृतीय संक्रमण श्रेणी अथवा 5d- श्रेणी – इस श्रेणी में इलेक्ट्रॉन 5d-कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व La (Z = 57) तथा Hf (Z = 72) से Hg (Z = 80) हैं। ये तत्त्व आवर्त सारणी के छठे आवर्त में स्थित हैं।
- चतुर्थ संक्रमण श्रेणी अथवा 6d- श्रेणी – इस श्रेणी में इलेक्ट्रॉन 6d-कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व Ac (Z = 89) तथा Rf (Z = 104) से कॉपरनिसियम (Z = 112) हैं। ये तत्त्व आवर्त सारणी के सातवें आवर्त में स्थित हैं।
आवर्त सारणी में स्थिति – आवर्त सारणी में संक्रमण तत्त्व (d.ब्लॉक तत्त्व) समूह 2 तथा समूह 13 के मध्य स्थित हैं। d-ब्लॉक तत्त्व s-ब्लॉक तथा p-ब्लॉकों के मध्य स्थित हैं। d-ब्लॉक तत्वों को संक्रमण’ की संज्ञा इसी कारण ही प्रदान की गई है। s-ब्लॉक के तत्त्व अत्यधिक विद्युत धनात्मक होते हैं तथा आयनिक यौगिकों के निर्माण की प्रवृत्ति प्रदर्शित करते हैं। इसके विपरीत p-ब्लॉक के तत्त्व विद्युत ऋणात्मक होते हैं। और इनमें सहसंयोजी यौगिकों को बनाने की प्रवृत्ति होती है। d-ब्लॉक तत्त्व इन दोनों के मध्य एक संक्रमण व्यवहार प्रदर्शित करते हैं अर्थात् उनका व्यवहार अत्यधिक विद्युत धनात्मक s-ब्लॉक तत्त्वों तथा अत्यन्त दुर्बल रूप से विद्युत धनात्मक p-ब्लॉक तत्त्वों के मध्य का होता है। इस कारण ही d-ब्लॉक तत्त्वों को संक्रमण तत्त्व (transition elements) कहा जाता है।