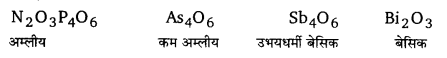UP Board Solutions for Class 12 Chemistry Chapter 7 The p Block Elements (p-ब्लॉक के तत्त्व)
अभ्यास के अन्तर्गत दिएर गए प्रश्नोत्तर
प्रश्न 1.
ट्राइसैलाइडों से पेन्टाहैलाइड अधिक सहसंयोजी क्यों होते हैं?
उत्तर
किसी अणु में केन्द्रीय परमाणु की जितनी उच्च धनात्मक ऑक्सीकरण अवस्था होती है, उसकी ध्रुवण क्षमता उतनी ही अधिक होती है जिसके कारण केन्द्रीय परमाणु और अन्य परमाणु के मध्य बने आबन्ध में सहसंयोजी गुण बढ़ता जाता है।
इस प्रकार चूंकि पेन्टालाइडों में केन्द्रीय परमाणु +5 ऑक्सीकरण अवस्था में होता है, जबकि ट्राइहैलाइडों में यह +3 ऑक्सीकरण अवस्था में होता है, इसलिए ट्राइलाइडों से पेन्टाहैलाइड अधिक सहसंयोजी होते हैं।
प्रश्न 2.
वर्ग 15 के तत्वों के हाइड्राइडों में BiH3 सबसे प्रबल अपचायक क्यों है?
उत्तर
वर्ग 15 के तत्वों के हाइड्राइडों में BiH3 के प्रबल अपचायक होने का कारण यह है कि इस वर्ग के हाइड्राइडों में Bi-H आबन्ध की लम्बाई सबसे अधिक होती है जिसके कारण BiH3 सबसे कम स्थायी होता है।
प्रश्न 3.
N2 कमरे के ताप पर कम क्रियाशील क्यों है?
उत्तर
N2 कमरे के ताप पर कम क्रियाशील होती है; क्योंकि प्रबल pπ – pπ अतिव्यापन के कारण त्रिओबन्ध N ≡ N बनता है।
प्रश्न 4.
अमोनिया की लब्धि को बढ़ाने के लिए आवश्यक स्थितियों का वर्णन कीजिए।
उत्तर
अमोनिया का निर्माण हेबर प्रक्रम से किया जाता है। इसकी लब्धि बढ़ाने के लिए ला-शातेलिए। सिद्धान्त के अनुसार आवश्यक स्थितियाँ निम्नवत् हैं –
- तापमान = 700 K
- उच्च दाब 200 x 105 Pa (लगभग 200 वायुमण्डल)
- उत्प्रेरक; जैसे- K2O तथा Al2O5 मिश्रित आयरन ऑक्साइड।
प्रश्न 5.
Cu2+ आयन के साथ अमोनिया कैसे क्रिया करती है?
उत्तर
Cu2+ आयन अमोनिया से क्रिया करके गहरे नीले रंग का संकुल बनाते हैं।

प्रश्न 6.
N2O5 में नाइट्रोजन की सहसंयोजकता क्या है?
उत्तर
सहसंयोजकता इलेक्ट्रॉनों के सहभाजित युग्मों की संख्या पर निर्भर करती है। चूंकि N2O5 में, प्रत्येक नाइट्रोजन परमाणु पर इलेक्ट्रॉनों के चार सहभाजित युग्म उपस्थित हैं जैसा कि निम्नवत् दिखाया गया है –

इसलिए N2O5 में N की सहसंयोजकता 4 है।
प्रश्न 7.
PH3 से PH+4 ई का आबन्ध कोण अधिक है। क्यों?
उत्तर
PH3 तथा PH+4 दोनों sp3 संकरित हैं। PH+4 में चारों कक्षक आबन्धित होते हैं, जबकि PH3 में P पर इलेक्ट्रॉनों का एकाकी युग्म उपस्थित होता है जो PH3 में एकाकी युग्म-आबन्ध युग्म प्रतिकर्षण के लिए उत्तरदायी है जिससे आबन्ध कोण 109°28′ से कम हो जाता है।

प्रश्न 8.
क्या होता है जब श्वेत फॉस्फोरस को CO2 के अक्रिय वातावरण में सान्द्र कॉस्टिक सोडा विलयन के साथ गर्म करते हैं?
उत्तर
श्वेत फॉस्फोरस NaOH से अभिक्रिया करके फॉस्फीन (PH3) बनाता है।
प्रश्न 9.
क्या होता है जब PCl5 को गर्म करते हैं?
उत्तर
PCl5 में तीन निरक्षीय (equatorial) [202 pm] तथा दो अक्षीय (axial) [240 pm] बन्ध होते हैं। चूंकि अक्षीय बन्ध निरक्षीय बन्धों से दुर्बल होते हैं, इसलिए जब PCl5 को गर्म किया जाता है तो कम स्थायी अक्षीय बन्ध टूटकर PCl3 बनाते हैं।
![]()
प्रश्न 10.
PCl5 की भारी पानी में जल-अपघटन अभिक्रिया का सन्तुलित समीकरण लिखिए।
उत्तर
PCl5 भारी जल (D2O) से अभिक्रिया करके फॉस्फोरस ऑक्सी-क्लोराइड (POCl3) तथा ड्यूटीरियम क्लोराइड (DCl) बनाता है।
PCl5 + D2O → POCl3 + 2 DCl
प्रश्न 11.
H3PO4 की क्षारकता क्या है?
उत्तर

H3PO4 अणु में तीन -OH समूह उपस्थित हैं, इसलिए इसकी क्षारकता 3 है।
प्रश्न 12.
क्या होता है जब H3PO4 को गर्म करते हैं?
उत्तर
ऑफॉस्फोरस अम्ल या फॉस्फोरस अम्ल (H3PO4) गर्म करने पर असमानुपातित होकर ऑर्थोफॉस्फोरिक अम्ल या फॉस्फोरिक अम्ल तथा फॉस्फीन देता है।

प्रश्न 13.
सल्फर के महत्त्वपूर्ण स्रोतों को सूचीबद्ध कीजिए।
उत्तर
भूपर्पटी में सल्फर की मात्रा 0.03 – 0.1% होती है। संयुक्त अवस्था में सल्फर सल्फेट के रूप में—जिप्सम (CaSO4 . 2H2O), एप्सम लवण (MgSO4 . 7H2O), बेराइट (BaSO4) तथा सल्फाइड के रूप में– गैलेना (PbS), जिंक ब्लैण्ड (ZnS), पाइराइट (CuFeS2) में पाया जाता है। कार्बनिक पदार्थों जैसे अण्डा, प्रोटीन, लहसुन, प्याज, सरसों, बाल तथा फर में सल्फर पाया जाता है। ज्वालामुखी में सल्फर के अंश H2S के रूप में पाए जाते हैं।
प्रश्न 14.
वर्ग 16 के तत्वों के हाइड्राइडों के तापीय स्थायित्व के क्रम को लिखिए।
उत्तर
चूँकि तत्वों का आकार वर्ग में नीचे जाने पर बढ़ता है, इसलिए E-H बन्ध वियोजन ऊर्जा घटती है। जिससे E-H बन्ध सरलता से टूट जाते हैं। अत: वर्ग 16 के तत्वों के हाइड्रोइडों का ऊष्मीय स्थायित्व वर्ग में नीचे जाने पर घटता है।
H2O > H2S > H2Se > H2Te > H2Po
प्रश्न 15.
H2O एक द्रव तथा H2S गैस क्यों है?
उत्तर
ऑक्सीजन के छोटे आकार तथा उच्च विद्युत ऋणात्मकता के कारण H2O में अन्तराआण्विक हाइड्रोजन बन्ध पाए जाने के परिणामस्वरूप यह कमरे के ताप पर द्रव होता है। H2S सल्फर के बड़े आकार के कारण हाइड्रोजन बन्ध नहीं बनाती है, अतः इसके अणुओं के मध्य दुर्बल वान्डर वाल्स बल कार्य करते हैं। इस कारण कक्ष ताप पर H2S गैस होती है।
प्रश्न 16.
निम्नलिखित में से कौन-सा तत्व ऑक्सीजन के साथ सीधे अभिक्रिया नहीं करता?
Zn, Ti, Pt, Fe
उत्तर
प्लैटिनम एक उत्कृष्ट धातु है। इसकी पहली चार आयनन एन्थैल्पियों का योग बहुत अधिक होता है, इसलिए यह ऑक्सीजन से सीधे संयोग नहीं करती है। दूसरी ओर Zn, Ti तथा Fe सक्रिय धातुएँ हैं, इसलिए ये ऑक्सीजन से सीधे संयोग करके संगत ऑक्साइड बनाती हैं।
प्रश्न 17.
निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए –
- C2H4 + O2 →
- 4 Al + 3O2 →
उत्तर
- C2H4 + 3O2 2CO2 ↑ + 2H2O
- 4Al + 3O2 2Al2O3
प्रश्न 18.
O3 एक प्रबल ऑक्सीकारक की तरह क्यों क्रिया करती है?
उत्तर
O3 शीघ्रता से अपघटित होकर नवजात ऑक्सीजन उत्पन्न करती है, जो विभिन्न पदार्थों को ऑक्सीकृत कर देती है। इसलिए यह प्रबल ऑक्सीकारक की तरह क्रिया करती है।
![]()
प्रश्न 19.
O3 का मात्रात्मक आकलन कैसे किया जाता है?
उत्तर
जब ओजोन पोटैशियम आयोडाइड के आधिक्य, जिसे बोरेट बफर (pH 9.2) के साथ बफरीकृत करते हैं, से अभिक्रिया करती है तो आयोडीन उत्पन्न होती है, इसे सोडियम थायोसल्फेट के मानक विलयन के साथ अनुमापित करते हैं। इस प्रकार O3 का मात्रात्मक आकलन किया जाता है।
प्रश्न 20.
तब क्या होता है जब सल्फर डाइऑक्साइड को Fe(III) लवण के जलीय विलयन में से प्रवाहित करते हैं?
उत्तर
SO2 अपचायक की भाँति कार्य करती है, इसलिए यह आयरन (III) लवण को आयरन (II) लवण में अपचयित कर देती है।
SO2 + 2H2O → SO2-4 + 4H+ + 2e–

प्रश्न 21.
दो S-O आबन्धों की प्रकृति पर टिप्पणी कीजिए जो SO2 अणु बनाते हैं। क्या SO2 अणु के ये दोनों S-O आबन्ध समतुल्य हैं?
उत्तर
SO2 में बनने वाले दोनों S-O आबन्ध सहसंयोजक (covalent) हैं तथा अनुनादी संरचनाओं के कारण समान रूप से प्रबल होते हैं।
प्रश्न 22.
SO2 की उपस्थिति का पता कैसे लगाया जाता है?
उत्तर
SO2 एक तीक्ष्ण गन्ध वाली गैस है। इसकी उपस्थिति को निम्नलिखित दो परीक्षणों से ज्ञात किया जा सकता है –
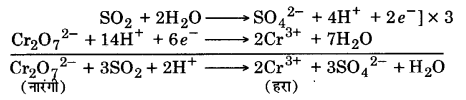
(i) SO2 गुलाबी-बैंगनी रंग के अम्लीय पोटैशियम परमैंगनेट (VII) विलयन को MnO–4 के Mn2+ आयन में अपचयन के कारण रंगहीन कर देती है।

(ii) SO2 अम्लीकृत K2Cr2O7 को Cr2O2-7 के Cr3+ आयनों में अपचयन के कारण हरा कर देती है।
प्रश्न 23.
उन तीन क्षेत्रों का उल्लेख कीजिए जिनमें H2SO4 महत्त्वपूर्ण भूमिका निभाता है।
उत्तर
- उर्वरकों; जैसे- अमोनियम सल्फेट, सुपर फॉस्फेट के निर्माण में।
- पेट्रोलियम शोधन में।
- सीसा संचायक बैटरियों में।
प्रश्न 24.
संस्पर्श प्रक्रम द्वारा H2SO4 की मात्रा में वृद्धि करने के लिए आवश्यक परिस्थितियों को लिखिए।
उत्तर
H2SO4 के निर्माण में प्रमुख पद SO2 का O2 के साथ उत्प्रेरकीय ऑक्सीकरण है। इसमें V2O5 उत्प्रेरक की उपस्थिति में SO3 प्राप्त होती है।
![]()
अभिक्रिया ऊष्माक्षेपी तथा उत्क्रमणीय है। अग्रगामी अभिक्रिया में आयतन का ह्रास होता है। इसलिए कम ताप तथा उच्च दाब उत्पाद की मात्रा में वृद्धि करने के लिए आवश्यक परिस्थितियाँ हैं, परन्तु ताप अत्यधिक कम नहीं होना चाहिए, अन्यथा अभिक्रिया की दर कम हो जाएगी।
प्रश्न 25.
जल में H2SO4 के लिए Ka2 << Ka1 क्यों है?
उत्तर
H2SO4 एक द्विक्षारकीय अम्ल है, यह दो पदों में आयनित होता है, इसलिए इसके दो वियोजन स्थिरांक होते हैं।
- H2SO4 (aq) + H2O (l) → H3O+ (aq) + HSO–4 (aq); Ka1 > 10
- HSO–4 (aq) + H2O (l) → H3O+ (aq) + SO2-4 (aq); Ka2 = 1.2 x 10-2
Ka1 (>10) के अधिक मान से तात्पर्य यह है कि H2SO4, H3O+ तथा HSO–4 में अधिक वियोजित है।
मुख्यत: H3O+ और H2SO–4 में प्रथम आयनन के कारण H2SO4 जल में प्रबल अम्ल है। HSO–4 का H3O+ तथा SO2-4 आयनों में आयनन लगभग नगण्य होता है;
अत: Ka2 << Ka1
प्रश्न 26.
आबन्ध वियोजन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा जलयोजन एन्थैल्पी जैसे प्राचलों को महत्त्व देते हुए F2 तथा Cl2 की ऑक्सीकारक क्षमता की तुलना कीजिए।
उत्तर
ऑक्सीकारक क्षमता F2 से Cl2 तक घटती है। जलीय विलयन में हैलोजेनों की ऑक्सीकारक क्षमता वर्ग में नीचे की ओर घटती है (F से Cl तक)। फ्लुओरीन का इलेक्ट्रोड विभव (+287 V) क्लोरीन (+136 V) की तुलना में उच्च होता है, इसलिए F2 क्लोरीन की तुलना में प्रबल ऑक्सीकारक है। इलेक्ट्रोड विभव निम्नलिखित प्राचलों पर निर्भर करता है –

अत: Fप्रबल ऑक्सीकारक है।
प्रश्न 27.
दो उदाहरणों द्वारा फ्लुओरीन के असामान्य व्यवहार को दर्शाइए।
उत्तर
फ्लुओरीन का असामान्य व्यवहार इसके-
- लघु आकार
- उच्च विद्युत ऋणात्मकता
- कम F-F आबन्ध वियोजन एन्थैल्पी तथा
- इसके संयोजी कोश में d-कक्षकों की अनुपलब्धता के कारण होता है।
उदाहरणार्थ –
- फ्लुओरीन केवल एक ऑक्सोअम्ल बनाती है, जबकि अन्य हैलोजेन अधिक संख्या में ऑक्सो- अम्लों का निर्माण करते हैं।
- हाइड्रोजन फ्लुओराइड प्रबल हाइड्रोजन बन्धों के कारण द्रव होता है, जबकि अन्य हाइड्रोजन हैलाइड गैसीय होते हैं।
प्रश्न 28.
समुद्र कुछ हैलोजेन का मुख्य स्रोत है। टिप्पणी कीजिए।
उत्तर
समुद्र जल में मैग्नीशियम, कैल्सियम, सोडियम तथा पोटैशियम के क्लोराइड, ब्रोमाइड तथा आयोडाइड पाए जाते हैं जिनमें सोडियम क्लोराइड (द्रव्यमान अनुसार 2.5%) प्रमुख हैं। समुद्री जमाव में सोडियम क्लोराइड तथा कार्नेलाइट [KCI . MgCl2 . 6H2O] प्रमुख होते हैं। कुछ समुद्री जीवधारियों के तन्त्र में आयोडीन पायी जाती है। कुछ समुद्री खरपतवारों ( लेमिनेरिया प्रजाति) में 0.5% आयोडीन तथा चिली साल्टपीटर में 0.2% सोडियम आयोडेट होता है।
प्रश्न 29.
Cl2 की विरंजक क्रिया का कारण बताइए। (2012)
उत्तर
Cl2 की विरंजक क्रिया ऑक्सीकरण के कारण होती है। नमी अथवा जलीय विलयन की उपस्थिति में Cl2 नवजात ऑक्सीजन मुक्त करती है।
![]()
यह नवजात ऑक्सीजन वनस्पतियों तथा कार्बनिक द्रव्यों में उपस्थित रंगीन पदार्थों का ऑक्सीकरण करके उन्हें रंगहीन पदार्थ में परिवर्तित कर देती है।
रंगीन पदार्थ + [O] → रंगहीन पदार्थ
अत: Cl2 की विरंजक क्रिया ऑक्सीकरण के कारण होती है।
प्रश्न 30.
उन दो विषैली गैसों के नाम लिखिए जो क्लोरीन गैस से बनाई जाती हैं?
उत्तर
फॉस्जीन (COCl2) तथा मस्टर्ड गैस (ClCH2CH2SCH2CH2Cl)।
प्रश्न 31.
I2 से ICl अधिक क्रियाशील क्यों है?
उत्तर
I2 से ICl अधिक क्रियाशील होता है क्योंकि I-I आबन्ध से I-Cl आबन्ध दुर्बल होता है। परिणामस्वरूप ICl सरलता से टूटकर हैलोजेन परमाणु देता है जो तीव्रता से अभिक्रिया करते हैं।
प्रश्न 32.
हीलियम को गोताखोरी के उपकरणों में उपयोग क्यों किया जाता है?
उत्तर
आधुनिक गोताखोरी के उपकरणों में हीलियम ऑक्सीजन के तनुकारी के रूप में उपयोग में आती है; क्योंकि रुधिर में इसकी विलेयता बहुत कम है।
प्रश्न 33.
निम्नलिखित समीकरण को सन्तुलित कीजिए –
XeF6 + H2O →XeO2F2 + HF
उत्तर
XeF6 + 2H2O → XeO2F2 + 4 HF
प्रश्न 34.
रेडॉन के रसायन का अध्ययन करना कठिन क्यों था?
उत्तर
रेडॉन अत्यन्त कम अर्द्धआयुकाल का रेडियोऐक्टिव तत्व है, इस कारण रेडॉन के रसायन का अध्ययन करना कठिन था।
अतिरिक्त अभ्यास
प्रश्न 1.
वर्ग 15 के तत्वों के सामान्य गुणधर्मो की उनके इलेक्ट्रॉनिक विन्यास, ऑक्सीकरण अवस्था, परमाण्विक आकार, आयनन एन्थैल्पी तथा विद्युत ऋणात्मकता के सन्दर्भ में विवेचना कीजिए।
उत्तर
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration) – इन तत्वों के संयोजी कोश का इलेक्ट्रॉनिक विन्यास ns2 , np3 होता है। इनमें s-कक्षक पूर्णतया भरे हुए तथा p- कक्षक अर्द्धपूरित होते हैं, जो इनके इलेक्ट्रॉनिक विन्यास को अधिक स्थायी बनाते हैं।
(ii) ऑक्सीकरण अवस्थाएँ (Oxidation states) – इन तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ -3, +3 तथा +5 हैं। तत्वों द्वारा -3 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति वर्ग में नीचे जाने पर परमाणु आकार तथा धात्विक गुण बढ़ने के कारण घटती है। वस्तुतः अन्तिम तत्व बिस्मथ कठिनता से -3 ऑक्सीकरण अवस्था में यौगिक बनाता है। ऑक्सीकरण अवस्था +5 का स्थायित्व वर्ग में नीचे जाने पर घटता है। इस अवस्था में केवल Bi(V) का यौगिक BiF5 ज्ञात है। ऑक्सीकरण अवस्था +5 तथा ऑक्सीकरण अवस्था +3 का स्थायित्व वर्ग में नीचे जाने पर क्रमशः घटता तथा बढ़ता है (अक्रिय युग्म प्रभाव)। नाइट्रोजन +1, +2, +4 ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है, जबकि यह ऑक्सीजन के साथ अभिकृत होता है। फॉस्फोरस कुछ ऑक्सोअम्लों में +1 तथा +4 ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है।
(iii) परमाणु आकार (Atomic size) – समूह में नीचे जाने पर सहसंयोजी तथा आयनिक त्रिज्याएँ बढ़ती हैं। N से P तक सहसंयोजी त्रिज्याओं में पर्याप्त वृद्धि होती है, जबकि As से Bi तक सहसंयोजी त्रिज्याओं में सूक्ष्म वृद्धि प्रेक्षित होती है। यह भारी सदस्यों में पूर्णतया भरे हुए d तथा f-कक्षकों की उपस्थिति के कारण होता है।
(iv) आयनन एन्थैल्पी (Ionisation enthalpy) – वर्ग में ऊपर से नीचे जाने पर आयनन एन्थैल्पी में परमाणु आकार में क्रमिक वृद्धि के कारण कमी आती है। इस प्रकार अधिक स्थायी अर्द्धपूरित p-कक्षक के इलेक्ट्रॉनिक विन्यास तथा छोटे आकार के कारण वर्ग 15 के तत्वों की आयनन एन्थैल्पी के मान वर्ग 14 के तत्वों से सम्बन्धित आवर्गों में अधिक होते हैं। आयनन एन्थैल्पी का उत्तरोत्तर बढ़ता क्रम निम्नवत् है –
ΔiHi < ΔiH2 < ΔiH3
(v) विद्युत ऋणात्मकता (Electronegativity) – किसी समूह में नीचे जाने पर परमाणु आकार बढ़ने के साथ विद्युत ऋणात्मकता सामान्यतः घटती है। यद्यपि भारी तत्वों में इस प्रकार का कोई विशेष प्रभाव नहीं पड़ता है।
प्रश्न 2.
नाइट्रोजन की क्रियाशीलता फॉस्फोरस से भिन्न क्यों है?
उत्तर
N2 अणु में उपस्थित N ≡ N बन्ध की अत्यधिक बन्ध वियोजन एन्थैल्पी (941.4 kJ mol-1) के कारण नाइट्रोजन अणु फॉस्फोरस अणु की तुलना में बहुत कम क्रियाशील हैं। फॉस्फोरस अणु (P4) में उपस्थित P-P बन्धों की बन्ध वियोजन एन्थैल्पी काफी कम (201.6 kJ mol-1) होती है।
प्रश्न 3.
वर्ग 15 के तत्वों की रासायनिक क्रियाशीलता की प्रवृत्ति की विवेचना कीजिए।
उत्तर
1. हाइड्राइड (Hydrides) – वर्ग 15 के सभी तत्व MH3 तथा MH4 प्रकार के हाइड्राइड बनाते हैं। (M = N, P, As, Sb, Bi)।
- क्षारीय गुण (Basic character) – हाइड्राइडों के क्षारीय गुण उनके आकार बढ़ने अर्थात् इलेक्ट्रॉन घनत्व घटने के साथ घटते हैं।

- ऊष्मीय स्थायित्व (Thermal stability) – वर्ग में नीचे जाने पर हाइड्राइडों का ऊष्मीय स्थायित्व घटता है क्योंकि परमाणु आकार बढ़ता है जिससे बन्ध लम्बाई (M – H) बढ़ती है।
- अपचायक गुण (Reducing character) – यह वर्ग में नीचे जाने पर बढ़ता है क्योंकि स्थायित्व घटता है। NH3 के अतिरिक्त सभी प्रबल अपचायक होते हैं।
- क्वथनांक (Boiling point) – NH3 का क्वथनांक हाइड्रोजन आबन्ध के कारण PH3 से अधिक होता है। क्वथनांक PH3 से आगे जाने पर बढ़ते हैं क्योंकि आण्विक द्रव्यमान बढ़ने के कारण वान्डर वाल्स बलों में वृद्धि होती है।
अभिक्रियाएँ –
- Ca3P2 + 6H2O → 2PH3 ↑ + 3 Ca(OH)2
- P4 + 3 KOH + 3H2O → PH3 ↑ + 3 KH2PO2
- 2NH3 + NaOCl → N2H4 + NaCl + H2O
2. हैलाइड (Halides) :
(i) ट्राइहैलाइड (Trihalides) – ये सभी प्रकार के हैलोजेनों से सीधे संयोग करके MX3 प्रकार के ट्राइलाइड बनाते हैं। NBr3 तथा NI3 को छोड़कर सभी ट्राइहैलाइड स्थायी तथा पिरैमिडी संरचना के होते हैं। BiF3 के अतिरिक्त सभी ट्राइहैलाइड सहसंयोजी प्रकृति के होते हैं। ट्राइहैलाइडों की सहसंयोजी प्रकृति तत्व के आकार के बढ़ने पर घटती है।

ट्राइहैलाइड सरलता से जल-अपघटित हो जाते हैं –
- NCl3 + 3H2O → NH3 ↑ + 3 HOCl
- PCl3 + 3H2O → H3PO3 + 3 HCl
- 4 AsCl3 + 6H2O → As4O6 + 12 HCl
- SbCl3 + H2O → SbOCl + 2 HCl
- BiCl3 + H2O → BiOCl + 2 HCl
फॉस्फोरस तथा एण्टीमनी के ट्राइहैलाइड लूइस अम्ल की भाँति व्यवहार करते हैं।
- PF3 + F2 → PF5
- SbF3 + 2F– → [SbF5]2-
(ii) पेन्टाहैलाइड (Pentahalides) – P, As तथा Sb सूत्र MCl5 के पेन्टालाइड बनाते हैं। N पेन्टाहलाइड नहीं बनाता है; क्योंकि इलेक्ट्रॉन के उत्तेजन के लिए d-कक्षक अनुपस्थित होते हैं। Bi अक्रिय-युग्म प्रभाव के कारण पेन्टाहैलाइड नहीं बनाता। पेन्टाक्लोराइडों में sp3 संकरण होता है तथा इनकी संरचना त्रिकोणीय द्विपिरैमिडी होती है।
3. ऑक्साइड (Oxides) – ये ऑक्सीजन से प्रत्यक्ष या अप्रत्यक्ष रूप से जुड़कर अधिक संख्या में ऑक्साइड बनाते हैं।
(i) नाइट्रोजन के ऑक्साइड (Oxides of nitrogen) – नाइट्रोजन ऑक्सीजन के साथ क्रिया करके कई प्रकार के ऑक्साइड बनाता है। इनका संक्षिप्त वर्णन निम्नांकित रूप में तालिकाबद्ध है –

(ii) फॉस्फोरस के ऑक्साइड (Oxides of phosphorus) – फॉस्फोरस के दो महत्त्वपूर्ण ऑक्साइड P4O6 (P2O3 का द्विलक) तथा P4O10 (P2O5 का द्विलक) हैं। इन्हें अग्रवत् प्राप्त किया जाता है –
P4 + 6O (सीमित) P4O6
P4 + 5O2 (आधिक्य) → P4O10
(iii) अन्य तत्वों के ऑक्साइड (Oxides of other elements) – As4O6, As2O5, Sb4O6, Sb2O5, Bi2O3 तथा Bi2O5.
N, P तथा As के ट्राइऑक्साइड अम्लीय होते हैं। अम्लीय गुण वर्ग में नीचे जाने पर घटता है। Sb का ऑक्साइड उभयधर्मी होता है, जबकि Bi का ऑक्साइड क्षारीय होता है। सभी पेन्टाऑक्साइड अम्लीय होते हैं। N2O5 प्रबलतम तथा Bi2O5 दुर्बलतम अम्लीय ऑक्साइड होता है।
(4) ऑक्सी-अम्ल (Oxy-acids) – Bi को छोड़कर अन्य सभी तत्व ऑक्सी-अम्लों (जैसे- HNO3, H3PO4, H3AsO4, तथा H2SbO4) का निर्माण करते हैं। ऑक्सी-अम्लों का सामर्थ्य तथा स्थायित्व वर्ग में नीचे जाने पर घटता है।

प्रश्न 4.
NH3 हाइड्रोजन बन्ध बनाती है, परन्तु PH3 नहीं बनाती, क्यों?
उत्तर
नाइट्रोजन की विद्युत ऋणात्मकता (3: O) हाइड्रोजन (2 : 1) से अधिक होती है। अत: N – H आबन्ध ध्रुवीय होता है। इसलिए NH3 में अन्तराआण्विक हाइड्रोजन आबन्ध होते हैं। इसके विपरीत P तथा H दोनों की विद्युत ऋणात्मकता 2 : 1 होती है, इसलिए PH बन्ध ध्रुवीय नहीं होता, अत: इसमें हाइड्रोजन बन्ध नहीं होता है।
प्रश्न 5.
प्रयोगशाला में नाइट्रोजन कैसे बनाते हैं? सम्पन्न होने वाली अभिक्रिया के रासायनिक समीकरणों को लिखिए।
उत्तर
प्रयोगशाला में अमोनियम क्लोराइड के सममोलर जलीय विलयन की सोडियम नाइट्राइट के साथ अभिक्रिया से नाइट्रोजन बनाते हैं। इस अभिक्रिया में द्विअपघटन के परिणामस्वरूप अमोनियम नाइट्राइट बनता है जो अस्थायी होने के कारण अपघटित होकर डाइनाइट्रोजन गैस बनाता है।
NH4Cl(aq) + NaNO2 (aq) → NH4NO2 (aq) + NaCl (aq)

प्रश्न 6.
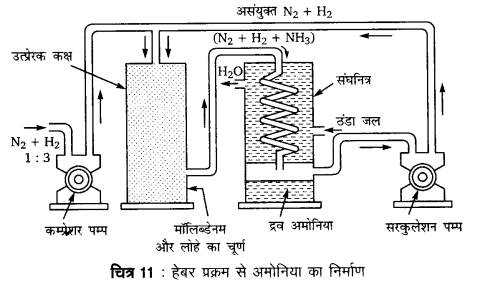
अमोनिया का औद्योगिक उत्पादन कैसे किया जाता है?
उत्तर
अमोनिया का औद्योगिक उत्पादन हेबर प्रक्रम से किया जाता है।
N2 (g) + 3H2 (g) 2NH3 (g), ΔfH– = – 46.1 kJ mol-1
शुष्क नाइट्रोजन तथा हाइड्रोजन को 1 : 3 में लेकर उच्च दाब (200 से 300 वायुमण्डल) तथा ताप । (723 K से 773 K) पर Al2O3 मिश्रित आयरन उत्प्रेरक पर प्रवाहित करने पर NH3 प्राप्त होती है। जिसे द्रवित करके तरल रूप में प्राप्त कर लेते हैं।
प्रश्न 7.
उदाहरण देकर समझाइए कि कॉपर धातु HNO3 के साथ अभिक्रिया करके किस प्रकार भिन्न उत्पाद दे सकती है?
उत्तर
तनु HNO3 कॉपर के साथ अभिक्रिया करके कॉपर नाइट्रेट तथा नाइट्रिक ऑक्साइड बनाता है, जबकि सान्द्र HNO3 कॉपर के साथ अभिक्रिया करके कॉपर नाइट्रेट तथा नाइट्रोजन डाइऑक्साइड बनाता है।

प्रश्न 8.
NOतथा N2O5 की अनुनादी संरचनाओं को लिखिए।
उत्तर
(i) NO2 की अनुनादी संरचनाएँ –

(ii) N2O5 की अनुनादी संरचनाएँ –

प्रश्न 9.
HNH कोण का मान, HPH, HAsH तथा HSbH कोणों की अपेक्षा अधिक क्यों होता है?
(संकेत- NH3 में sp3 संकरण के आधार तथा हाइड्रोजन और वर्ग के दूसरे तत्वों के बीच केवल s-p आबंधन के द्वारा व्याख्या की जा सकती है।)
उत्तर
MH3 प्रकार के हाइड्राइडों में केन्द्रीय परमाणु M इलेक्ट्रॉनों के तीन बन्ध युग्मों (bond pairs) तथा एक एकल युग्म (lone pair) से निम्न प्रकार से घिरा रहता है –

नाइट्रोजन परमाणु का आकार में बहुत छोटे तथा अधिक विद्युत ऋणात्मक होने के कारण NH3 में N परमाणु पर इलेक्ट्रॉन घनत्व का मान अधिकतम होता है। इस कारण बन्ध युग्मों के मध्य अधिकतम प्रतिकर्षण होता है और इस कारण HNH बन्ध कोण का मान अधिकतम होता है। परमाणु आकार में वृद्धि होने के कारण N से Bi की ओर जाने पर M की विद्युत ऋणात्मकता घटती है। फलस्वरूप इलेक्ट्रॉन युग्मों के मध्य प्रतिकर्षण कम हो जाता है। यही कारण है कि NH3 से BiH3 की ओर जाने पर H-M-H बन्ध कोण घटता है।
प्रश्न 10.
R3P = O पाया जाता है जबकि R3N = O नहीं, क्यों (R = ऐल्किल समूह)?
उत्तर
d- ऑर्बिटलों की अनुपस्थिति के कारण, N अपनी सहसंयोजकता को 4 से अधिक करने में और dπ – pπ बन्धों का निर्माण करने में असमर्थ है। इस कारण, यह R3N = O प्रकार के यौगिकों का निर्माण नहीं करता है। इसके विपरीत P के पास d- ऑर्बिटल होते हैं और यह dπ – pπ बहुल बन्ध बनाने में सक्षम है। अत: यह अपनी सहसंयोजकता को 5 तक बढ़ाकर R3P = 0 प्रकार के यौगिक बनाता है।
प्रश्न 11.
समझाइए कि क्यों NH3 क्षारकीय है, जबकि BiH3 केवल दुर्बल क्षारक है?
उत्तर
N परमाणु का आकार (70 pm), Bi के परमाणु आकार (148 pm) की तुलना में काफी कम है। इस कारण NH3 में N परमाणु पर इलेक्ट्रॉन घनत्व का मान BiH3 में Bi पर इलेक्ट्रॉन घनत्व के मान से काफी अधिक होता है। इस कारण BiH3 की तुलना में NH3 अधिक प्रभावशाली ढंग से इलेक्ट्रॉनों के एकल युग्म को दे सकता है। यही कारण है कि BiH3 की तुलना में NH3 अधिक क्षारीय है।
प्रश्न 12.
नाइट्रोजन द्विपरमाणुक अणु के रूप में पाया जाता है तथा फॉस्फोरस P4 के रूप में, क्यों?
उत्तर
छोटे परमाणु आकार तथा अधिक विद्युत ऋणात्मकता के कारण नाइट्रोजन में स्वयं से pπ – pπ बहुल बन्धों को बनाने की प्रबल प्रवृत्ति होती है। इस प्रकार, यह N ≡ N बन्ध का निर्माण कर एक द्वि-परमाणविक अणु (N2 ) के रूप में पाया जाता है। इसके विपरीत, बड़े परमाणु आकार तथा कम विद्युत ऋणात्मकता के कारण फॉस्फोरस में स्वयं से pπ – pπ बहुल बन्धों को बनाने की प्रवृत्ति नहीं होती है। अत: यह P – P एकल बन्धों को बनाकर एक समचतुष्फलकीय P4 अणु का निर्माण करता है।
प्रश्न 13.
श्वेत फॉस्फोरस तथा लाल फॉस्फोरस के गुणों की मुख्य भिन्नताओं को लिखिए।
उत्तर
श्वेत फॉस्फोरस तथा लाल फॉस्फोरस के गुणों की मुख्य भिन्नताएँ निम्नलिखित हैं –

श्वेत तथा लाल फॉस्फोरस की संरचनाएँ निम्नवत् होती हैं –

प्रश्न 14.
फॉस्फोरस की तुलना में नाइट्रोजन श्रृंखलन गुणों को कम प्रदर्शित करती है, क्यों?
उत्तर
शृंखलन का गुण तत्व की बन्ध प्रबलता पर निर्भर करता है। चूंकि N-N बन्ध की प्रबलता (159 kJ mol-1), P-P बन्ध की प्रबलता (212 kJ mol-1) से कम होती है, इसलिए नाइट्रोजन फॉस्फोरस की तुलना में कम श्रृंखलन गुणों को दर्शाती है।
प्रश्न 15.
H3PO3 की असमानुपातन अभिक्रिया दीजिए।
उत्तर
गर्म किये जाने पर H3PO3 निम्न प्रकार से असमानुपातन प्रदर्शित करता है –
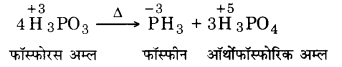
प्रश्न 16.
क्या PCl5 ऑक्सीकारक और अपचायक दोनों का कार्य कर सकता है? तर्क दीजिए।
उत्तर
PCl5 में P की ऑक्सीकरण अवस्था +5 है जो P की उच्चतम ऑक्सीकरण अवस्था है। अतः, यह अपनी ऑक्सीकरण अवस्था को +5 से अधिक प्रदर्शित नहीं कर सकता है, अर्थात् इसे और अधिक ऑक्सीकृत नहीं किया जा सकता है। इस प्रकार यह अपचायक की भाँति व्यवहार नहीं कर सकता है। इसके विपरीत, यह आसानी से एक ऑक्सीकारक की भाँति व्यवहार कर सकता है क्योंकि यह अपनी ऑक्सीकरण अवस्था को +5 से घटाकर +3 कर सकता है।

प्रश्न 17.
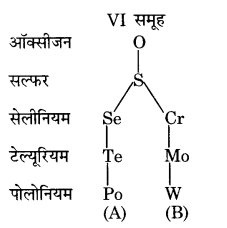
O, Se, Te तथा Po को इलेक्ट्रॉनिक विन्यास, ऑक्सीकरण अवस्था तथा हाइड्राइड निर्माण के सन्दर्भ में आवर्त सारणी के एक ही वर्ग में रखने का तर्क दीजिए।
उत्तर
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration)-इन सभी तत्वों का संयोजी कोश इलेक्ट्रॉनिक विन्यास समान, ns2 np2 (n = 2 से 6 तक) होता है। इससे इन तत्वों को आवर्त सारणी के वर्ग 16 में रखा जाना चरितार्थ होता है।

(ii) ऑक्सीकरण अवस्था (Oxidation state) – इन्हें समीपवर्ती अक्रिय गैस विन्यास प्राप्त करने के लिए अर्थात् द्विऋणात्मक आयन बनाने के लिए दो अतिरिक्त इलेक्ट्रॉनों की आवश्यकता पड़ती है, इसलिए इन तत्वों की न्यूनतम ऑक्सीकरण अवस्था -2 होनी चाहिए। ऑक्सीजन विशिष्ट रूप से तथा सल्फर कुछ मात्रा में विद्युत ऋणात्मक होने के कारण -2 ऑक्सीकरण अवस्था प्रदर्शित करते हैं। इस वर्ग के अन्य तत्व, 0 तथा S से अधिक विद्युत ऋणात्मक होने के कारण ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित नहीं करते हैं। चूंकि इन तत्वों के संयोजी कोश में 6 इलेक्ट्रॉन होते हैं, इसलिए ये तत्व अधिकतम +6 ऑक्सीकरण अवस्था प्रदर्शित कर सकते हैं। इन तत्वों द्वारा प्रदर्शित अन्य धनात्मक ऑक्सीकरण अवस्थाएँ +2 तथा +4 हैं। यद्यपि ऑक्सीजन 4-कक्षकों की अनुपस्थिति के कारण +4 तथा +6 ऑक्सीकरण अवस्थाएँ प्रदर्शित नहीं करता, अतः न्यूनतम तथा अधिकतम ऑक्सीकरण अवस्थाओं के आधार पर इन तत्वों को समान वर्ग अर्थात् वर्ग 16 में रखा जाना पूर्णतया न्यायोचित है।
(iii) हाइड्राइडों का निर्माण (Formation of hydrides) – सभी तत्व अपने संयोजी इलेक्ट्रॉनों में से दो इलेक्ट्रॉनों की हाइड्रोजन के 1s-कक्षक के साथ सहभागिता करके अपने-अपने अष्टक पूर्ण कर लेते हैं। तथा सामान्य सूत्र EH, के हाइड्राइड बनाते हैं; जैसे- H2O, H2S, H2Se. H2Te तथा H2Po, इसलिए सामान्य सूत्र EH2 वाले हाइड्राइड बनाने के आधार पर इन तत्वों को समान वर्ग अर्थात् वर्ग 16 में रखा जाना पूर्णतया न्यायोचित है।
प्रश्न 18.
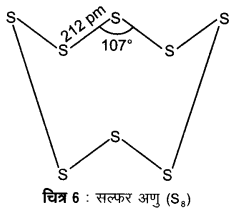
क्यों डाइऑक्सीजन एक गैस है, जबकि सल्फर एक ठोस है?
उत्तर
ऑक्सीजन pπ – pπ बहुल बन्ध बनाता है। छोटे आकार तथा उच्च विद्युत ऋणात्मकता के कारण ऑक्सीजन द्विपरमाणुक अणु (O2) के रूप में पाया जाता है। ये अणु परस्पर दुर्बल वाण्डर वाल्स आकर्षण बलों द्वारा जुड़े रहते हैं जो कमरे के ताप पर अणुओं के संघट्टों द्वारा सरलता से हट जाते हैं। अत: O2 कमरे के ताप पर एक गैस होती है।
सल्फर अपने विशाल आकार तथा कम विद्युत ऋणात्मकता के कारण pπ – pπ बहुल बन्ध नहीं बनाता है, अपितु यह S – S एकल बन्ध बनाते हैं। पुनः O – O एकल बन्धों से अधिक प्रबल S – S बन्धों के कारण सल्फर में श्रृंखलन का गुण ऑक्सीजन से अधिक होता है। अत: सल्फर श्रृंखलन की उच्च प्रवृत्ति तथा pπ – pπ बहुल बन्ध बनाने की अल्प प्रवृत्ति के कारण अष्टपरमाणुक अणु (S8) बनाता है जिसकी संकुचित वलय संरचना (puckered ring structure) होती है। विशाल आकार के कारण S8 अणुओं को परस्पर बाँधे रखने वाले आकर्षण बल पर्याप्त प्रबल होते हैं जिन्हें कमरे के ताप पर अणुओं के संघट्टों द्वारा नहीं हटाया जा सकता है। अत: सल्फर कमरे के ताप पर एक ठोस होता है।
प्रश्न 19.
यदि O → O– तथा O → O2- के इलेक्ट्रॉन लब्धि एन्थैल्पी मान पता हों, जो क्रमशः 141 तथा 702 kJ mol-1 हैं तो आप कैसे स्पष्ट कर सकते हैं कि O2- स्पीशीज वाले ऑक्साइड अधिक बनते हैं न कि O– वाले?
(संकेत-यौगिकों के बनने में जालक ऊर्जा कारक को ध्यान में रखिए।)
उत्तर
O2- मूलक युक्त ऑक्साइडों (अर्थात् MO प्रकार के ऑक्साइड) की जालक ऊर्जा (lattice energy) का मान O2- मूलक युक्त ऑक्साइडों (अर्थात् M2O प्रकार के ऑक्साइड) की जालक ऊर्जाओं से काफी अधिक होता है क्योंकि O2- तथा M2+ पर आवेश की मात्रा अधिक होती है। इसलिए O → O2- की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान O → O– के सम्बन्धित मान की तुलना में काफी अधिक होने के बाद भी MO का निर्माण M2O के निर्माण की तुलना में ऊर्जा की दृष्टि से अधिक सम्भाव्य है। यही कारण है कि MO प्रकार के ऑक्साइडों की संख्या M2O प्रकार के ऑक्साइडों की तुलना में काफी अधिक है।
प्रश्न 20.
कौन-से ऐरोसॉल्स ओजोन को कम करते हैं?
उत्तर
क्लोरोफ्लोरोकार्बन (CFC) ऐरोसॉल जैसे-फ्रियोन (CCl2F2) वायुमण्डल के स्ट्रेटोस्फियर : (stratosphere) में उपस्थित ओजोन पर्त को विच्छेदित करते हैं। निहित अभिक्रियाएँ निम्न हैं –

प्रश्न 21.
संस्पर्श प्रक्रम द्वारा H2SO4 के उत्पादन का वर्णन कीजिए। (2009, 12, 15, 16)
उत्तर
संस्पर्श विधि द्वारा H2SO4 का उत्पादन
(Production of H2SO4 by Contact Process)
सल्फ्यूरिक अम्ल का उत्पादन संस्पर्श प्रक्रम द्वारा तीन चरणों में सम्पन्न होता है।
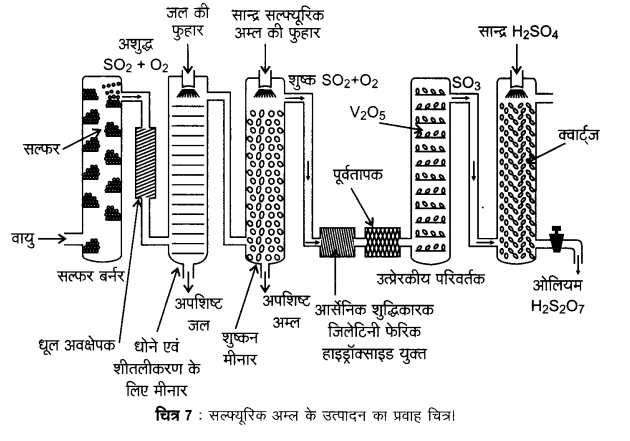
- सल्फर अथवा सल्फाइड अयस्कों को वायु में जलाकर सल्फर डाइऑक्साइड का उत्पादन करना।
- उत्प्रेरक (V2O5) की उपस्थिति में ऑक्सीजन के साथ अभिक्रिया कराकर SO2 का SO3 में परिवर्तन करना।
- SO3 को सल्फ्यूरिक अम्ल में अवशोषित करके ओलियम (H2S2O7) प्राप्त करना।
सल्फ्यूरिक अम्ल के उत्पादन का प्रवाह चित्र, चित्र-7 में दिया गया है।
प्राप्त सल्फर डाइऑक्साइड को धूल के कणों एवं आर्सेनिक यौगिकों जैसी अन्य अशुद्धियों से मुक्त कर शुद्ध कर लिया जाता है।
सल्फ्यूरिक अम्ल के उत्पादन में ऑक्सीजन द्वारा SO2 गैस का V2O5 उत्प्रेरक की उपस्थिति में SO3 प्राप्त करने के लिए उत्प्रेरकी ऑक्सीकरण मूल पद है।
![]()
यह अभिक्रिया ऊष्माक्षेपी तथा उत्क्रमणीय है एवं अग्र अभिक्रिया में आयतन में कमी आती है। अतः कम ताप और उच्च दाब उच्च लब्धि (yield) के लिए उपयुक्त स्थितियाँ हैं, परन्तु तापक्रम बहुत कम नहीं होना चाहिए अन्यथा अभिक्रिया की गति धीमी हो जाएगी। सल्फ्यूरिक अम्ल के उत्पादन में प्रयुक्त संयन्त्र का संचालन 2 bar दाब तथा 720 K ताप पर किया जाता है। उत्प्रेरकी परिवर्तक से प्राप्त SO3 गैस, सान्द्र सल्फ्यूरिक अम्ल,में अवशोषित होकर ओलियम (H2S2O7) बना देती है। जल द्वारा ओलियम का तनुकरण करके वांछित सान्द्रता वाला सल्फ्यूरिक अम्ल प्राप्त कर लिया जाता है। प्रक्रम के सतत संचालन तथा लागत में भी कमी लाने के लिए उद्योग में उपर्युक्त दोनों प्रक्रियाएँ साथ-साथ सम्पन्न की जाती हैं।
- SO3 + H2SO4 → H2S2O7
- H2S2O7 + H2O → 2 H2SO4
संस्पर्श विधि द्वारा सल्फ्यूरिक अम्ल की शुद्धता सामान्यतः 96 – 98% होती है।
प्रश्न 22.
SO2 किस प्रकार से एक वायु प्रदूषक है?
उत्तर
SO2 एक अत्यन्त हानिकारक गैस है। वायुमण्डल में इसकी उपस्थिति से श्वसन रोग, हृदय रोग, गले तथा आँखों में अनेक परेशानियाँ उत्पन्न होती हैं। यह अम्ल वर्षा (acid rain) का मुख्य कारण है। अम्ल वर्षा जन्तुओं, वनस्पतियों एवं भवनों के लिए अत्यन्त घातक है। अम्ल वर्षा से सम्बन्धित प्रकाश-रासायनिक अभिक्रियाएँ निम्न हैं –
- SO2 + hv → SO2
- SO2 + O2 → SO3 + O
- SO2 + SO2 → SO3 + SO
- SO + SO2 → SO3 + S
- SO + H2O → H2SO4
इस प्रकार, SO2 एक घातक वायु प्रदूषक है।
प्रश्न 23.
हैलोजेन प्रबल ऑक्सीकारक क्यों होते हैं?
उत्तर
हैलोजेनों में अल्प आबन्ध वियोजन एन्थैल्पी, उच्च विद्युत ऋणात्मकता तथा अधिक ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी के कारण इलेक्ट्रॉन ग्रहण करके अपचयित होने की प्रबल प्रवृत्ति होती है।
X + e– → X–
अत: हैलोजेन प्रबल ऑक्सीकरण कर्मक या ऑक्सीकारक होते हैं। यद्यपि इनकी ऑक्सीकारक क्षमता F2 से I2 तक घटती है जैसा कि इनके इलेक्ट्रोड विभवों से सत्यापित होता है –

इसलिए F2 प्रबलतम तथा I2 दुर्बलतम ऑक्सीकारक होता है।
प्रश्न 24.
स्पष्ट कीजिए कि फ्लुओरीन केवल एक ही ऑक्सो-अम्ल, HOF क्यों बनाता है?
उत्तर
फ्लोरीन सर्वाधिक विद्युत ऋणात्मक तत्त्व है और केवल -1 ऑक्सीकरण अवस्था ही प्राप्त कर सकती है। इसका परमाणु आकार भी काफी कम होता है। इस कारण यह उच्च ऑक्सी अम्लों जैसे- HOXO, HOXO2 तथा HOXO3 आदि में केन्द्रीय परमाणु के रूप में स्थित नहीं हो पाती है और केवल एक ही ऑक्सी अम्ल HOF का निर्माण करती है। इस अम्ल में इसकी ऑक्सीकरण अवस्था-1 है।
प्रश्न 25.
व्याख्या कीजिए कि क्यों लगभग एकसमान विद्युत ऋणात्मकता होने के पश्चात् भी नाइट्रोजन हाइड्रोजन आबन्ध निर्मित करता है, जबकि क्लोरीन नहीं।
उत्तर
यद्यपि O तथा Cl दोनों की विद्युत ऋणात्मकताओं के मान लगभग समान हैं, तथापि उनके परमाणु आकार काफी भिन्न होते हैं (O = 66 pm, Cl = 99 pm)। इस कारण Cl परमाणु की तुलना में O परमाणु पर इलेक्ट्रॉन घनत्व का मान काफी अधिक होता है। इस कारण ही ऑक्सीजन तो हाइड्रोजन बन्ध बनाने में सक्षम है, लेकिन Cl नहीं।
प्रश्न 26.
ClO2 के दो उपयोग लिखिए।
उत्तर
- ClO2 एक शक्तिशाली ऑक्सीकारक तथा क्लोरीनीकारक है। अत: इसका उपयोग जल के शुद्धीकरण में किया जाता है।
- यह एक उत्कृष्ट विरंजक (bleaching agent) है और इसका उपयोग कागज की लुगदी तथा वस्त्रों के विरंजन में किया जाता है।
प्रश्न 27.
हैलोजेन रंगीन क्यों होते हैं? (2014)
उत्तर
सभी हैलोजेन रंगीन होते हैं। इसका कारण यह है कि इनके अणु दृश्य क्षेत्र में प्रकाश अवशोषित कर लेते हैं जिसके फलस्वरूप इनके इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा स्तरों में चले जाते हैं, जबकि शेष प्रकाश उत्सर्जित हो जाता है। हैलोजेनों का रंग वास्तव में इस उत्सर्जित प्रकाश का रंग होता है। उत्तेजन के लिए आवश्यक ऊर्जा की मात्रा परमाणु आकार के अनुसार F से I तक लगातार घटती है, अतः उत्सर्जित प्रकाश की ऊर्जा F से I तक बढ़ती है। दूसरे शब्दों में, हैलोजेन का रंग F2 से I2 तक गहरा होता जाता है।
उदाहरणार्थ– F2 बैंगनी प्रकाश अवशोषित करके हल्का पीला दिखाई देता है, जबकि आयोडीन पीला तथा हरा प्रकाश अवशोषित करके गहरा बैंगनी रंग का प्रतीत होता है। इसी प्रकार हम Cl2 के हरे-पीले तथा ब्रोमीन के नारंगी-लाल रंग की व्याख्या कर सकते हैं।
प्रश्न 28.
जल के साथ F2 तथा Cl2 की अभिक्रियाएँ लिखिए।
उत्तर
प्रबल ऑक्सीकारक होने के कारण F, जल को 0, या 0; में ऑक्सीकृत कर देता है।
- 2F2 (g) + 2H2O (l) → 4HF (aq) + O2 (g)
- 3F2 (g) + 3H2O (l) → 6HF (aq) + O3 (g)
Cl2 जल से क्रिया कर हाइड्रोक्लोरिक तथा हाइपोक्लोरस अम्लों का निर्माण करता है।
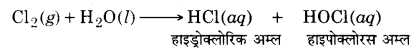
प्रश्न 29.
आप HCl से Cl2 तथा Cl2 से HCl को कैसे प्राप्त करेंगे? केवल अभिक्रियाएँ लिखिए।
उत्तर
- HCl से cl2 :
- MnO2 (s) + 4HCl (aq) → MnCl2 (aq) + 2H2O (l) + Cl2 (g)
- Cl2 से HCl :
- Cl2 (g) + H2 (g) → 2HCl (g)
प्रश्न 30.
एन-बार्टलेट Xe तथा PtF6 के बीच अभिक्रिया कराने के लिए कैसे प्रेरित हुए?
उत्तर
नील बार्टलेट ने प्रेक्षित किया कि PtF6 की अभिक्रिया O2 से होने पर एक आयनिक ठोस O+2PtF–6 प्राप्त होता है।
O2 (g) + PtF6 (g) → O+2[PtF6]–
यहाँ O2, PtF6 द्वारा O+2 में ऑक्सीकृत हो जाता है।
बार्टलेट ने पाया कि Xe की प्रथम आयनन एन्थैल्पी (1170 kJ mol-1) O2 अणुओं की प्रथम आयनन एन्थैल्पी (1175 kJ mol-1) के लगभग समान है, इसलिए PtF6 द्वारा Xe को Xe+ में ऑक्सीकृत करना चाहिए। इस प्रकार वे Xe तथा PtF6 के बीच अभिक्रिया कराने के लिए प्रेरित हुए। जब Xe तथा PtF6 को मिश्रित किया गया, तब एक तीव्र अभिक्रिया हुई तथा सूत्र Xe+PtF–6 का एक लाल ठोस पदार्थ प्राप्त हुआ।
Xe + PtF6 xe+ [PtF6]–
प्रश्न 31.
निम्नलिखित में फॉस्फोरस की ऑक्सीकरण अवस्थाएँ क्या हैं?
(i) H2PO2
(ii) PCl3
(iii) Ca3P2
(iv) Na3PO4
(v) POF3
उत्तर
माना कि फॉस्फोरस की ऑक्सीकरण अवस्था : है –

प्रश्न 32.
निम्नलिखित के लिए सन्तुलित समीकरण दीजिए –
(i) जब NaCl को MnO2 की उपस्थिति में सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है।
(ii) जब क्लोरीन गैस को NaI के जलीय विलयन में से प्रवाहित किया जाता है।
उत्तर

(ii) Cl2 (g) + 2NaI (aq) → 2NaCl (aq) + I2 (s)
प्रश्न 33.
जीनॉन फ्लुओराइड XeF2, XeF4 तथा XeF6 कैसे बनाए जाते हैं?
उत्तर
जीनॉन फ्लुओराइडों को Xe तथा F2 के मध्य विभिन्न परिस्थितियों में सीधे अभिक्रिया द्वारा प्राप्त किया जाता है।
- Xe (g) + F2 (g) XeF2 (s)
- Xe (g) + 2F2 (g) XeF4 (s)
- Xe (g) + 3F2 (g) XeF6 (s)
प्रश्न 34.
किस उदासीन अणु के साथ ClO– समइलेक्ट्रॉनी है? क्या यह अणु एक लूइस क्षारक है?
उत्तर
ClO– में कुल 17 + 8 + 1 = 26 इलेक्ट्रॉन हैं। यह ClF अणु से समइलेक्ट्रॉनिक है क्योंकि ClF में भी 17 + 9 = 26 इलेक्ट्रॉन उपस्थित हैं। ClF एक लूइस बेस की भाँति व्यवहार करता है क्योंकि – F में क्लोरीन परमाणु पर इलेक्ट्रॉनों के तीन एकल युग्म (lone pairs) उपस्थित हैं। यह पुनः F से क्रिया कर ClF3 बना सकती है।
प्रश्न 35.
XeO3 तथा XeF4 किस प्रकार बनाए जाते हैं?
उत्तर
XeF4 तथा XeF6 के जल-अपघटन पर XeO3 बनता है।
- 6XeF4 + 12H2O → 4Xe + 2XeO3 + 24HF + 3O2 ↑
- XeF6 + 3H2O → XeO3 + 6HF
जीनॉन तथा फ्लु ओरीन को 1 : 5 अनुपात में लेकर 873 K तथा 7 bar पर अभिक्रिया कराने पर XeF4 बनता है।
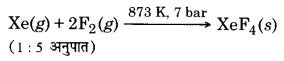
प्रश्न 36.
निम्नलिखित प्रत्येक समुच्चय को सामने लिखे गुणों के अनुसार सही क्रम में व्यवस्थित कीजिए –
- F2, Cl2, Br2, I2 – आबन्ध वियोजन एन्थैल्पी बढ़ते क्रम में।
- HF, HCl, HBr, HI – अम्ल सामर्थ्य बढ़ते क्रम में।
- NH3, PH3, AsH3, SbH3, BiH3 – क्षारक सामर्थ्य बढ़ते क्रम में।
उत्तर
1. F2 से I2 तक आबन्ध दूरी बढ़ने पर आबन्ध वियोजन एन्थैल्पी घटती है क्योंकि F से I की ओर जाने पर परमाणु के आकार में वृद्धि होती है। यद्यपि F-F आबन्ध वियोजन एन्थैल्पी, Cl – Cl की तुलना में कम होती है तथा Br – Br की आबन्ध वियोजन एन्थैल्पी से भी कम होती है। इसका कारण यह है कि F परमाणु अत्यधिक छोटा होता है तथा प्रत्येक F परमाणु पर इलेक्ट्रॉनों के तीन एकाकी युग्म F2 अणु में F-परमाणुओं को बाँधे रखने वाले आबन्ध युग्मों को प्रतिकर्षित करते हैं। अत: आबन्ध वियोजन एन्थैल्पी का बढ़ता क्रम इस प्रकार होता है- I2 < F2 < Br2 < Cl2.
2. HF, HCl, HBr, HI की आपेक्षिक अम्ल सामर्थ्य इनकी आबन्ध वियोजन एन्थैल्पी पर निर्भर करती है। F से I तक परमाणु का आकार बढ़ने पर H-X आबन्ध की आबन्ध वियोजन एन्थैल्पी H – F से H – I तक घटती है। इसलिए अम्ल सामर्थ्य विपरीत क्रम में इस प्रकार बढ़ता है –
HF < HCl < HBr < HI.
3. NH3, PH3, AsH3, BiH3 में केन्द्रीय परमाणु पर इलेक्ट्रॉनों के एकाकी युग्म की उपस्थिति के कारण ये सभी लुईस क्षारों की भाँति व्यवहार करते हैं। यद्यपि NH3 से BiH3 तक जाने पर परमाणु का आकार बढ़ता है, परिणामस्वरूप इलेक्ट्रॉनों का एकाकी युग्म अधिक आयतन घेर लेता है। दूसरे शब्दों में, केन्द्रीय परमाणु पर इलेक्ट्रॉन घनत्व घटता है तथा क्षारक सामर्थ्य NH3 से BiH3 तेक घटती है, इसलिए क्षारक सामर्थ्य का बढ़ता क्रम है- BiH3 < SbH3 < AsH3 < PH3 < NH3 .
प्रश्न 37.
निम्नलिखित में से कौन-सा एक अस्तित्व में नहीं है?
- XeOF4
- NeF2
- XeF2
- XeF6.
उत्तर
NeF2 अस्तित्व में नहीं है। इसका कारण यह है कि फ्लोरीन Ne को Ne+2 में ऑक्सीकृत नहीं कर सकता क्योंकि Ne की प्रथम तथा द्वितीय आयनन एन्थैल्पी के योग का मान Xe की तुलना में काफी अधिक है। इसलिए XeF2, XeOF4, तथा XeF6 प्राप्त किये जा सकते हैं, लेकिन NeF2 नहीं।
प्रश्न 38.
उस उत्कृष्ट गैस स्पीशीज का सूत्र देकर संरचना की व्याख्या कीजिए जो कि इनके साथ समसंरचनीय है –
- ICl–4
- IBr–2
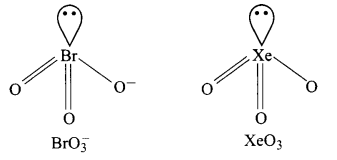
- BrO–3
उत्तर
1. ICl–4, XeF4 से समइलेक्ट्रॉनिक है। दोनों वर्ग समतलीय हैं।

2. IBr–2, XeF2 से समइलेक्ट्रॉनिक है। दोनों रेखीय हैं।

3. BrO–3, XeO3 से समइलेक्ट्रॉनिक है। दोनों पिरामिडीय आकृति के होते हैं।
प्रश्न 39.
उत्कृष्ट गैसों के परमाण्विक आकार तुलनात्मक रूप से बड़े क्यों होते हैं?
उत्तर
उत्कृष्ट गैसों की परमाण्विक त्रिज्या अपने सम्बन्धित आवर्गों में सर्वाधिक होती है। इसका कारण यह है कि उत्कृष्ट गैसों की त्रिज्या केवल वाण्डर वाल्स त्रिज्या होती है (क्योंकि ये अणु नहीं बनाती हैं), जबकि अन्यों की सहसंयोजक त्रिज्याएँ होती है। वाण्डर वाल्स त्रिज्या सहसंयोजक त्रिज्या से अधिक होती है, अतः उत्कृष्ट गैसों के परमाण्विक आकार तुलनात्मक रूप से बड़े होते हैं।
प्रश्न 40.
निऑन तथा आर्गन गैसों के उपयोग सूचीबद्ध कीजिए।
उत्तर
निऑन के उपयोग (Uses of Neon) –
- निऑन का उपयोग विसर्जन ट्यूब तथा प्रदीप्त बल्बों में विज्ञापन प्रदर्शन हेतु किया जाता है।
- निऑन बल्बों का उपयोग वनस्पति उद्यान तथा ग्रीन हाउस में किया जाता है।
आर्गन के उपयोग (Uses of Argon) –
- आर्गन का उपयोग उच्चताप धातुकर्मीय प्रक्रमों में अक्रिय वातावरण उत्पन्न करने के लिए किया जाता है ( धातुओं तथा उपधातुओं के आर्क वेल्डिंग में)।
- इसका उपयोग विद्युत-बल्ब को भरने के लिए किया जाता है।
- प्रयोगशाला में इसका उपयोग वायु सुग्राही पदार्थों के प्रबन्धन में भी किया जाता है।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
निम्नलिखित में सर्वाधिक स्थायी है – (2017)
(i) AsH3
(ii) SbH3
(iii) pH3
(iv) NH3
उत्तर
(iv) NH3
प्रश्न 2.
सफेद फॉस्फोरस को किस द्रव में रखते हैं? (2012)
(i) जल
(ii) केरोसीन
(iii) एथिल ऐल्कोहॉल
(iv) क्लोरोफॉर्म
उत्तर
(i) जल
प्रश्न 3.
निम्नलिखित में से किसकी अभिक्रिया से फॉस्फोरस से फॉस्फीन बनाया जाता है? (2017)
(i) HCl
(ii) NaOH
(iii) CO2
(iv) CO2
उत्तर
(ii) NaOH
प्रश्न 4.
अमोनिया और फॉस्फीन गैसों के कौन-से निम्नलिखित गुण में भिन्नता है? (2011)
(i) अणु संरचनाओं में
(ii) क्लोरीन के साथ अभिक्रियाओं में
(iii) अपचायक गुण में
(iv) वायु में जलने में
उत्तर
(iv) वायु में जलने में
प्रश्न 5.
SO2 अणु में सल्फर परमाणु का संकरण है – (2017)
(i) sp
(ii) SP2
(iii) sp3
(iv) sp3d
उत्तर
(ii) sp2
प्रश्न 6.
प्रबल विद्युत ऋणात्मक हैलोजन है – (2017)
(i) F2
(ii) Cl2
(iii) Br2
(iv) I2
उत्तर
(i) F2
प्रश्न 7.
सर्वाधिक इलेक्ट्रॉन बन्धुता वाला तत्त्व है –
(i) N
(ii) 0
(iii) Cl
(iv) F
उत्तर
(iii) Cl
प्रश्न 8.
F, Ci, Br तथा I तत्त्वों के इलेक्ट्रॉन बन्धुता का सही क्रम है – (2016)
(i) F > Cl > Br > I
(ii) I > Br > Cl > F
(iii) F > Br > Cl > I
(iv) F > Cl > Br > I
उत्तर
(i) F > Cl > Br > I
प्रश्न 9.
निम्न में से कौन-सा कथन सही है? (2012)
(i) NO2 नाइट्रिक अम्ल का ऐनहाइड्राइड है
(ii) CO फॉर्मिक अम्ल का ऐनहाइड्राइड है
(iii) Cl2O3 हाइपोक्लोरस अम्ल का ऐनहाइड्राइड है
(iv) Cl2O7 परक्लोरिक अम्ल का ऐनहाइड्राइड है
उत्तर
(iv) Cl2O7 परक्लोरिक अम्ल का ऐनहाइड्राइड है
प्रश्न 10.
निम्न में से विस्फोटक है – (2013)
(i) Hg2Cl2
(ii) PCl3
(iii) NCl3
(iv) SbCl3
उत्तर
(iii) NCl3
प्रश्न11.
क्लोरीन का प्रबलतम ऑक्सी अम्ल है – (2016)
(i) HClO2
(ii) HClO4
(iii) HClO
(iv) HClO3
उत्तर
(ii) HClO4
प्रश्न12.
निष्क्रिय गैसों की खोज का श्रेय जाता है – (2012)
(i) रैले को
(ii) विलियम रैमसे को
(iii) जॉनसन को
(iv) डेवार को
उत्तर
(i) रैले को
प्रश्न 13.
वायुमण्डल में सर्वाधिक पायी जाने वाली गैस है – (2017)
(i) हीलियम
(ii) निऑन
(iii) आर्गन
(iv) क्रिप्टन
उत्तर
(iii) आर्गन
प्रश्न14.
निम्न में से कौन-सी गैस वायुयानों के टायरों में भरी जाती है? (2012)
(i) H,
(ii) He
(iii) Np
(iv) Ar
उत्तर
(ii) He
प्रश्न15.
वायुमण्डल में पायी जाने वाली अक्रिय गैस है – (2011)
(i) He तथा Ne
(ii) He, Ne तथा Ar
(iii) He, Ne, Ar तथा Kr
(iv) Rn को छोड़कर सभी
उत्तर
(iv) Rn को छोड़कर सभी
प्रश्न16.
हीलियम का मुख्य स्रोत है – (2012)
(i) वायु
(ii) मोनाजाइट रेत
(iii) रेडियम
(iv) इनमें से कोई नहीं
उत्तर
(ii) मोनोजाइट रेत
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
अमोनिया की क्लोरीन से क्या अभिक्रिया होती है? (2014)
उत्तर
अमोनिया की क्लोरीन से अभिक्रिया निम्नलिखित दो प्रकार से होती है –
- जब अमोनिया आधिक्य में होती है तो N2 तथा NH4Cl प्राप्त होते हैं।
- 8 NH3 + 3 Cl2 → N2 ↑ + 6 NH4Cl
- जब क्लोरीन आधिक्य में होती है तो NCl3 तथा HCl प्राप्त होते हैं।
- NH3 + 3 Cl2 → NCl3 + 3 HCl
प्रश्न 2.
नाइट्रस अम्ल, ऑक्सीकारक एवं अपचायक दोनों के रूप में कार्य करता है। प्रत्येक को एक-एक उदाहरण देकर समझाइए। (2010, 12)
उत्तर
नाइट्रस अम्ल अपघटित होकर नवजात ऑक्सीजन देता है
2HNO2 → 2NO ↑ + [O] + H2O
नवजात ऑक्सीजन विभिन्न पदार्थों को ऑक्सीकृत कर देती है। इसके विपरीत यह प्रबल ऑक्सीकारकों के प्रति अपचायक का कार्य भी करती है, क्योंकि यह उनमें नवजात ऑक्सीजन ग्रहण करके स्वयं नाइट्रिक अम्ल में बदल जाती है।
HNO2 + [O] → HNO3
उदाहरण –
- ऑक्सीकारक गुण – नाइट्रस अम्ल सल्फर डाइऑक्साइड को सल्फ्यूरिक अम्ल में ऑक्सीकृत कर देता है।
- SO2 + 2HNO2 → H2SO4 + 2NO
- अपचायक गुण – नाइट्रस अम्ले H2O2 को H2O में अपचयित कर देता है।
- H2O2 + HNO2 → HNO3 + H2O
प्रश्न 3.
फॉस्फोरस के अपररूप लिखिए। (2017)
उत्तर
फॉस्फोरस के तीन मुख्य अपररूप निम्नवत् हैं –
- सफेद या पीला फॉस्फोरस
- लाल फॉस्फोरस
- काला फॉस्फोरस
प्रश्न 4.
सफेद फॉस्फोरस से लाल फॉस्फोरस कैसे प्राप्त किया जाता है? (2015)
उत्तर
सफेद फॉस्फोरस को निष्क्रिय वातावरण में 240°C ताप पर गर्म करने से वह लाल फॉस्फोरस में बदल जाता है।

प्रश्न 5.
फॉस्फोरस के निम्नलिखित ऑक्सी अम्लों के संरचना सूत्र लिखिए – (2017)
(i) हाइपो फॉस्फोरिक अम्ल
(ii) फॉस्फोरिक अम्ल
(iii) ऑर्थों फॉस्फोरिक अम्ल
(iv) पाइरो फॉस्फोरिक अम्ल
उत्तर

प्रश्न 6.
एक अभिक्रिया लिखिए जिसमें ओजोन अपचायक हो परन्तु स्वयं भी अपचयित होती है – (2017)
उत्तर
ओजोन हाइड्रोजन परॉक्साइड को जल में अपचयित करती है और स्वयं भी अपचयित हो जाती है।
H2O2 + O3 → 2O2 ↑ + H2O
प्रश्न 7.
सल्फर के किन्हीं चार ऑक्सी अम्लों के नाम लिखिए। (2017)
उत्तर
- H2SO4 (सल्फ्यूरिक अम्ल)
- H2S2O7 (डाइसल्फ्यूरिक अम्ल)
- H2S2O3 (थायोसल्फ्यूरिक अम्ल)
- H2S2O6 (डाइथायोनिक अम्ल)
प्रश्न 8.
रासायनिक समीकरण देते हुए SO2 की विरंजक क्रिया का कारण समझाइए। (2012, 17)
उत्तर
SO2 अपचयन के आधार पर विरंजक गुण व्यक्त करती है।
SO2 + 2H2O → H2SO4 + 2[H]
रंगीन पदार्थ + [H] → रंगहीन पदार्थ
प्रश्न 9.
जल की अपेक्षा आयोडीन, KI विलयन में क्यों अधिक विलेय है? (2009)
उत्तर
जल के द्वारा आयोडीन का बिल्कुल भी अपघटन नहीं होता है जबकि आयोडीन KI विलयन में घुलकर भूरे रंग का पोटैशियम ट्राइआयोडाइड (KI3) संकर यौगिक बनाती है।
KI + I2 → KI3
प्रश्न10.
सामान्य ताप एवं दाब पर ब्रोमीन एक द्रव है जबकि आयोडीन ठोस। कारण स्पष्ट कीजिए। (2014)
उत्तर
आयोडीन का अणुभार तथा आकार दोनों ब्रोमीन से अधिक हैं चूंकि आयोडीन अणु के मध्य लगने वाला आणविक आकर्षण बल ब्रोमीन की तुलना में अधिक है, इसलिए आयोडीन ठोस तथा ब्रोमीन द्रव है।
प्रश्न 11.
हैलोजनों के दो ऑक्सी अम्लों के संरचना सूत्र लिखिए। (2016, 17)
उत्तर
हैलोजनों के दो ऑक्सी अम्लों के संरचना सूत्र निम्नवत् हैं –

प्रश्न 12.
HCl का क्वथनांक HF से कम क्यों होता है? (2016)
उत्तर
हाइड्रोजन हैलाइडों के क्वथनांक HCl से HI तक बढ़ते हैं। HF का क्वथनांक अन्तराअणुक हाइड्रोजन आबन्धन के कारण अपसामान्य रूप से इन सबसे उच्च है।
प्रश्न 13.
उत्कृष्ट प्रैसे क्या होती हैं? उत्कृष्ट गैसों के नाम लिखिए। (2009)
उत्तर
आवर्त सारणी में शून्य वर्ग के तत्त्वों को उत्कृष्ट गैसें कहते हैं, क्योंकि ये तत्त्व रासायनिक रूप से अक्रिय होते हैं। हीलियम, आर्गन, निऑन, रेडॉन, क्रिप्टॉन तथा जीनॉन उत्कृष्ट गैसें हैं।
प्रश्न 14.
अक्रिय गैसों की चार विशेषताएँ/गुण लिखिए। (2009, 10)
उत्तर
अक्रिय गैसों के गुण –
- ये रंगहीन, गंधहीन तथा स्वादहीन गैसें हैं।
- इनकी अन्तिम कक्षा का विन्यास ns2np6 (हीलियम को छोड़कर) होता है।
- इनकी संयोजकता शून्य होती है।
- ये एक परमाणुक गैसें हैं, जिनकी विशिष्ट ऊष्माओं का अनुपात (Cp/Cυ) 1.66 होता है।
प्रश्न15.
अक्रिय गैसों की इलेक्ट्रॉन बन्धुता शून्य क्यों होती है? (2017)
उत्तर
क्योंकि इनके अन्दर और बाहर के सभी कोश पूर्ण रूप से भरे होते हैं।
प्रश्न 16.
उत्कृष्ट गैसें अक्रिय क्यों होती हैं? इनके द्वारा बनाये गये दो यौगिकों के सूत्र लिखिए। (2010, 13, 16)
उत्तर
उत्कृष्ट या अक्रिय गैसों के सभी कक्ष पूर्णतया भरे होने के कारण ये संतृप्त होती हैं और इसी कारण रासायनिक रूप से निष्क्रिय होती हैं। इन तत्त्वों के आयनन विभव स्थायी इलेक्ट्रॉन कक्ष होने के कारण उच्च होते हैं, अतः ये रासायनिक क्रिया में भाग नहीं लेते हैं। इनके द्वारा बनाये गये दो यौगिक क्रमश: WHe2 व Ar6H2O हैं।
प्रश्न 17.
उत्कृष्ट गैसों के आयनन विभव के मान ऊँचे होते हैं? समझाइए। (2013, 15)
उत्तर
उत्कृष्ट गैसों के उच्च आयनन विभव इनके छोटे आकार के कारण होते हैं।
प्रश्न 18.
कारण सहित स्पष्ट कीजिए कि He उत्कृष्ट गैसों में सबसे ज्यादा निष्क्रिय है। (2013)
उत्तर
उत्कृष्ट गैसों की आयनन ऊर्जाओं का क्रम निम्नवत् होता है –
He > Ne > Ar > Kr > Xe > Rn.
इससे स्पष्ट है कि He की आयनन ऊर्जा सर्वोच्च है। अत: इसमें से इलेक्ट्रॉन निष्कासित करना आसान नहीं है। इसी के आधार पर हम यह कह सकते हैं कि He उत्कृष्ट गैसों में सबसे ज्यादा निष्क्रिय है।
प्रश्न 19.
He और Ne फ्लोरीन के साथ यौगिक नहीं बनाते हैं क्यों? (2017)
उत्तर
He और Ne के फ्लोरीन के साथ यौगिक न बनाने के प्रमुख कारण निम्नलिखित हैं –
- छोटा आकार
- d कक्षक की अनुपस्थिति
- उच्च आयनन ऊर्जा
प्रश्न 20.
अक्रिय गैसों में सबसे अधिक यौगिक बनाने वाली अर्थात् सबसे अधिक क्रियाशील गैस का नाम एवं इसके कोई भी दो यौगिकों के सूत्र लिखिए। (2009, 11, 12)
उत्तर
जीनॉन। यौगिक :
- जीनॉन डाइफ्लुओराइड (XeF2)
- जीनॉन टेट्राफ्लुओराइड (XeF4)
प्रश्न 21.
हीलियम तथा निऑन के मिश्रण को पृथक् करने की विधि लिखिए। (2011)
उत्तर
हीलियम तथा निऑन के मिश्रण को 180°C पर चारकोल के सम्पर्क में लाने पर He मुक्त हो। जाती है तथा निऑन अधिशोषित हो जाती है। इसको गर्म करने पर निऑन प्राप्त की जा सकती है।
प्रश्न 22.
निष्क्रिय वातावरण के लिए किस अक्रिय गैस का प्रयोग किया जाता है और क्यों? (2012)
उत्तर
आर्गन को, क्योंकि यह किसी पदार्थ से क्रिया नहीं करती है।
प्रश्न 23.
रेडॉन की खोज किसने की? इसका किस रोग के उपचार में उपयोग किया जाता है? (2010, 12, 17)
उत्तर
रेडॉन (Rn) की खोज डॉर्न ने की थी। इसका प्रयोग कैंसर के उपचार में किया जाता है।
प्रश्न 24.
88Ra266 से प्राप्त होने वाली अक्रिय गैस का नाम तथा इसका प्रमुख उपयोग लिखिए। (2012)
उत्तर
88Ra266 के रेडियोऐक्टिव विघटन से रेडॉन (Rn) गैस प्राप्त होती है।
88Ra266 → 86Ra222 + 2He4
इसका उपयोग कैंसर के उपचार में तथा रेडियोऐक्टिवता के शोध कार्य में किया जाता है।
प्रश्न 25.
क्लीवाइट खनिज में कौन-सी अक्रिय गैस पाई जाती है? इस गैस का एक उपयोग लिखिए। (2018)
उत्तर
क्लीवाइट खनिज में हीलियम गैस पाई जाती है। यह गैस वायुयान के टायरों में भरी जाती है।
लघु उत्तरीय प्रश्न
प्रश्न 1.
NF5 नहीं बनता है जबकि PF ज्ञात है। समझाइए। (2014)
उत्तर
नाइट्रोजन (N) 1s2,2s2,2p3 में निम्न ऊर्जा का रिक्त d-कक्षक उपलब्ध नहीं होता है इसलिए नाइट्रोजन अपने अष्टक का प्रसार नहीं कर पाता है अर्थात् अपने वाह्य कोश में 8 से अधिक इलेक्ट्रॉन नहीं रख सकता है जिसके कारण NF5 नहीं बन पाता है।
चूँकि फॉस्फोरस में निम्न ऊर्जा का रिक्त 3d -कक्षक उपलब्ध है इसलिए यह अपने अष्टक का प्रसार करता है अर्थात् अपने बाह्य कोश में 8 से अधिक इलेक्ट्रॉन रख सकता है जिसके कारण PF5 बनता है।

PF5 में फॉस्फोरस के पाँच सहसंयोजक हैं तथा फॉस्फोरस के बाह्य कोश में कुल 10 इलेक्ट्रॉन हैं।
प्रश्न 2.
अमोनिया तथा फॉस्फीन बनाने की प्रयोगशाला विधि का रासायनिक समीकरण लिखिए तथा सफेद फॉस्फोरस की क्लोरीन से अभिक्रिया का रासायनिक समीकरण भी लिखिए। (2016)
उत्तर
अमोनिया गैस बनाने की प्रयोगशाला विधि का रासायनिक समीकरण – प्रयोगशाला में अमोनिया गैस अमोनियम क्लोराइड को बुझे हुए चूने के साथ गर्म करके बनायी जाती है।
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
फॉस्फीन गैस बनाने की प्रयोगशाला विधि का रासायनिक समीकरण – प्रयोगशाला में फॉस्फीन गैस वायु की अनुपस्थिति में सफेद फॉस्फोरस को सान्द्र कास्टिक सोडा विलयन के साथ गर्म करके बनायी जाती है।

सफेद फॉस्फोरस की क्लोरीन से अभिक्रिया का रासायनिक समीकरण – सफेद फॉस्फोरस साधारण ताप पर क्लोरीन गैस में स्वत: जलने लगता है।
P4 + 6Cl2 → 4PCl3
P4 + 10Cl2 → 4PCl5
प्रश्न 3.
फॉस्फीन बनाने की प्रयोगशाला विधि का सचित्र वर्णन कीजिए। इसके दो गुण एवं उपयोग लिखिए। (2009, 10, 12, 13, 16, 17, 18)
उत्तर
प्रयोगशाला में फॉस्फीन को सान्द्र सोडियम हाइड्रॉक्साइड को अक्रिय वातावरण में सफेद फॉस्फोरस के साथ उबालकर प्राप्त करते हैं।
P4 + 3NaOH + 3H2O → 3NaH2PO2 + PH3 ↑

इसके दो प्रमुख गुण निम्नवत् हैं –
- यह वायु से भारी तथा जल में अल्प विलेय होती है।
- यह विषैली प्रकृति की होती है।
इसके दो प्रमुख उपयोग निम्नवत् हैं –
- इसका उपयोग धातुओं के फॉस्फाइड बनाने में किया जाता है।
- इसका उपयोग समुद्री यात्राओं में होम्ज सिग्नल के लिए किया जाता है।
प्रश्न 4.
अमोनिया तथा फॉस्फीन के दो रासायनिक विभेदीय परीक्षण लिखिए। (2014)
उत्तर
- अमोनिया जलीय कॉपर सल्फेट के साथ गहरा नीला विलयन बनाती है जबकि फॉस्फीन जलीय कॉपर सल्फेट के साथ कॉपर फॉस्फाइड बनाती है।
- अमोनिया सान्द्र HCl के साथ सघन श्वेत धूम देती है जबकि फॉस्फीन HCl से क्रिया करके फॉस्फोनियम क्लोराइड बनाती है।
प्रश्न 5.
होम्ज सिग्नल में किस गैस का प्रयोग किया जाता है और कैसे? (2010)
उत्तर
होम्ज सिग्नल में फॉस्फीन गैस का प्रयोग किया जाता है। इस कार्य के लिए कैल्सियम फॉस्फाइड व कैल्सियम कार्बाइड से भरे हुए दो डिब्बे छेद करके समुद्र में डाल दिये जाते हैं। जल के सम्पर्क में आने पर फॉस्फीन तथा ऐसीटिलीन दोनों ही साथ-साथ जलती हैं।
- Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 ↑
- CaC2 + 2H2O → Ca(OH)2 + C2H2 ↑
फॉस्फीन शीघ्र ज्वलनशील होने के कारण ऐसीटिलीन को जला देती है जिससे प्रकाश उत्पन्न होता है तथा दूर से ऐसा लगता है कि समुद्र में आग लग रही है। इस प्रकार से सूचना समुद्री जहाज के चालकों को मिल जाती है।
प्रश्न 6.
डाइऑक्सीजन के विरचन की प्रमुख विधियाँ तथा इसके रासायनिक गुण एवं उपयोग लिखिए। (2016)
उत्तर
विरचन की विधियाँ
- ब्रिन विधि – बेरियम ऑक्साइड वायु में 500°C पर गर्म करने पर बेरियम परॉक्साइड में बदल जाता है तथा बेरियम परॉक्साइड 800°C पर गर्म करने से पुन: BaO और O2 में अपघटित हो जाता है।
- 2 BaO + O2 2BaO2
- 2BaO2 2BaO + O2
- प्रयोगशाला विधि – प्रयोगशाला में ऑक्सीजन गैस पोटैशियम क्लोरेट और मैंगनीज डाइऑक्साइड के मिश्रण को 340°C तक गर्म करके बनायी जाती है।

रासायनिक गुण
ऑक्सीकारक गुण – लगभग सभी तत्त्व ऑक्सीजन से सीधे संयोग करके ऑक्साइड बनाते हैं।
- C + O2 → CO2 + ऊष्मा + प्रकाश
- S + O2 → SO2 + ऊष्मा + प्रकाश
- 4P + SO2 → 2P2O5 + ऊष्मा + प्रकाश
- 3Fe + 2O2 → Fe3O4
- CH4 + 2O2 → CO2 + 2H2O
उपयोग
- ऑक्सीकारक के रूप में
- श्वसन में,
- रासायनिक उद्योगों में
- ऑक्सी-ऐसीटिलीन ज्वाला प्राप्त करने में
प्रश्न 7.
सीमेन्स और हाल्सके ओजोनाइजर द्वारा ओजोन के निर्माण का सचित्र वर्णन कीजिए तथा पोटैशियम फैरोसायनाइड और स्टेनस क्लोराइड पर इसकी अभिक्रियाओं के रासायनिक समीकरण लिखिए। (2016)
उत्तर
सीमेन्स और हाल्सके ओजोनाइजर द्वारा ओजोन का औद्योगिक निर्माण – ओजोन का औद्योगिक निर्माण सीमेन्स और हाल्सके (Siemens and Halske) ओजोनाइजर द्वारा किया जाता है। इस ओजोनाइजर की रचना संलग्न चित्र में प्रदर्शित है। यह ओजोनाइजर लोहे का एक बॉक्स होता है जिसमें काँच या पॉर्सिलेने की कई बेलनाकार नलियाँ होती हैं। इन नलियों में ऐलुमिनियम की छड़े लगी होती हैं। जिनका निचला सिरा काँच की प्लेट पर टिका रहता है। ये छड़े इलेक्ट्रोडों का कार्य करती हैं।
उपकरण को ठण्डा रखने के लिए बेलनाकार नलियों के चारों ओर ठण्डा जल लगातार प्रवाहित किया जाता है। लोहे के बॉक्स को भू-सम्पर्कित करके छड़ों को लगभग 10 हजार वोल्ट के विभव पर रखा जाता है। ओजोनाइजर के निचले भाग से शुद्ध और शुष्क ऑक्सीजन गैस की मन्द धारा ओजोनाईजर में प्रवाहित की जाती है। छड़ों और नलियों के बीच के वलयाकार अन्तराल (annular space) में ऑक्सीजन प्रवेश करती है तथा ऊपर की ओर उठती है और ओजोन में परिवर्तित हो जाती है। बाहर निकलने वाली ओजोनित ऑक्सीजन में ओजोन आयतन से 10% तक होती है।

ओजोन की पोटैशियम फैरोसायनाइड से अभिक्रिया
यह पोटैशियम फैरोसायनाइड को पोटैशियम फैरीसायनाड में ऑक्सीकृत करती है।

ओजोन की स्टेनस क्लोराइड से अभिक्रिया
यह स्टैनस क्लोराइड को स्टैनिक क्लोराइड में ऑक्सीकृत करती है।
![]()
प्रश्न 8.
ओजोन एक ऑक्सीकारक एवं अपचायक पदार्थ है। उदाहरणों द्वारा समीकरण देते हुए इस कथन की पुष्टि कीजिए। (2012)
उत्तर
ओजोन एक ऑक्सीकारक एवं अपचायक दोनों है। इसे हम निम्नलिखित उदाहरणों द्वारा समझ सकते हैं –
- ऑक्सीकारक गुण – ओजोन जल की उपस्थिति में सल्फर को सल्फ्यूरिक अम्ल में ऑक्सीकृत कर देती है।
- S + H2O + 3O3 → H2SO4 + 3O2
- अपचायक गुण – ओजोन बेरियम परॉक्साइड को बेरियम मोनोऑक्साइड में अपचयित कर देती है।
- BaO2 + O3 → BaO + 2O2 ↑
प्रश्न 9.
ओजोन की मर्करी, शुष्क आयोडीन तथा स्टैनस क्लोराइड से अभिक्रिया का रासायनिक समीकरण लिखिए। (2016)
उत्तर
- ओजोन की मर्करी से अभिक्रिया का समीकरण
ओजोन मर्करी को मयूरस ऑक्साइड में ऑक्सीकृत कर देती है।

- ओजोन की शुष्क आयोडीन से अभिक्रिया का समीकरण
ओजोन शुष्क आयोडीन को पीले रंग के ऑक्साइड (I4O9) में ऑक्सीकृत कर देती है।

- ओजोन की स्टैनस क्लोराइड से अभिक्रिया का समीकरण
ओजोन स्टैनस क्लोराइड को स्टैनिक क्लोराइड में ऑक्सीकृत कर देती है।

प्रश्न 10.
‘सल्फर के अपररूप’ पर टिप्पणी लिखिए। (2016)
उत्तर
सल्फर के अनेक क्रिस्टलीय अपररूप ज्ञात हैं; जैसे- रोम्बिक सल्फर (rhombic sulphur or d-sulphur), मोनोक्लाइनिक सल्फर (monoclinic sulphur or B-sulphur), अमॉरफस सल्फर (amorphous sulphur), कोलॉइडी सल्फर (colloidal sulphur), प्लास्टिक सल्फर (plastic sulphur) आदि। रीम्बिक सल्फर और मोनोक्लाइनिक सल्फर, सल्फर के दो मुख्य अपररूप हैं। रोम्बिक और मोनोक्लाइनिक सल्फर दोनों के क्रिस्टल S8 अणुओं से बने होते हैं किन्तु क्रिस्टलों में अणओं की व्यवस्था में अन्तर होता है। साधारण ताप पर सल्फर का स्थायी रूप रोम्बिक सल्फर है। गर्म करने पर 95.6°C पर रोम्बिक सल्फर धीरे-धीरे मोनोक्लाइनिक सल्फर में बदल जाती है। 95.6°C से ऊपर के किसी ताप से ठण्डा करने पर मोनोक्लाइनिक सल्फर 95.6°C पर पुन: रोम्बिक सल्फर में बदल जाती है।
![]()
95.6°C से नीचे सल्फर का स्थायी रूप रोम्बिक रूप और 95.6°C से ऊपर मोनोक्लाइनिक रूप विद्यमान होता है।
प्रश्न 11.
सल्फर डाइऑक्साइड के निर्माण की प्रयोगशाला विधि का वर्णन कीजिए। इसके ऑक्सीकारक और अपचायक गुण देते हुए इसके उपयोग भी दीजिए। (2016, 17)
उत्तर
प्रयोगशाला विधि – प्रयोगशाला में सल्फर डाइऑक्साइड गैस कॉपर धातु की छीलन को सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म करके बनाई जाती है।
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
ऑक्सीकारक गुण – सल्फर डाइऑक्साइड अनेक क्रियाओं में ऑक्सीकारक का कार्य करती हैं; जैसे-
- H2S का S में ऑक्सीकरण
- 2H2S + SO2 → 3S + 2H2O
- आयरन का फेरस ऑक्साइड में ऑक्सीकरण
- 3Fe + SO2 → 2FeO + FeS
अपचायक गुण – सल्फर डाइऑक्साइड अनेक क्रियाओं में अपचायक का कार्य करती हैं; जैसे-
- K2Cr2O7 का Cr2(SO4)3 में अपचयन
- K2Cr2O7 + H2SO4 + 3SO2 → K2SO4 + Cr2(SO4)3 + H2O
- Cl को HCl में अपचयन
- Cl2 + 2H2O + SO2 → H2SO4 + 2HCl
उपयोग
- ऑक्सीकारक के रूप में
- अपचायक के रूप में
- कीटाणु और रोगाणुनाशक के रूप में
- चीनी उद्योग में
प्रश्न 12.
सीसा कक्ष विधि द्वारा सल्फ्यूरिक अम्ल के निर्माण का सचित्र वर्णन कीजिए। संयंत्र के प्रत्येक भाग में होने वाली रासायनिक अभिक्रियाओं के रासायनिक समीकरण भी दीजिए। (2016, 18)
उत्तर
सीसा कक्ष विधि द्वारा सल्फ्यूरिक अम्ल का निर्माण करने में सल्फर डाइऑक्साइड, वायु और नाइट्रिक ऑक्साइड (उत्प्रेरक) मिश्रण के भाग से क्रिया कराने पर सल्फ्यूरिक अम्ल प्राप्त होता है।

इस विधि द्वारा सल्फ्यूरिक अम्ल का निर्माण करने में प्रयुक्त संयंत्र संलग्न चित्र में प्रदर्शित है। इस संयंत्र के गुणक भाग और उनमें होने वाली रासायनिक अभिक्रियाओं के रासायनिक समीकरण निम्नवत् हैं –
1. पाइराइट बर्नर –
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- S +O2 → SO2
2. धूल कक्ष – पाइराइट बर्नर में प्राप्त सल्फर डाइऑक्साइड गैस और वायु के मिश्रण को धूल कक्ष में भेजा जाता है। इस कक्ष में गैसीय मिश्रण भाप के सम्पर्क में आता है और उसमें उपस्थित धूल के कण भारी होकर कक्ष की पेंदी में बैठ जाते हैं।

3. नाइटर पात्र

4. ग्लोवर टावर
- SO2 + NO2 + H2O → H2SO4 + NO
- 2(NO . HSO4) + H2O → 2H2SO4 + NO2 + NO
5. सीसा कक्ष
- 2SO2 + O2 + 2NO + 2H2O → 2H2SO4 + 2NO
6. गे-लुसैक टावर
- 2H2SO4 + NO + NO2 → 2(NO . HSO4) + H2O
प्रश्न 13.
सल्फ्यूरिक अम्ल एक ऑक्सीकारक एवं निर्जलीकारक है। इसके एक-एक उदाहरण दीजिए। (2009, 10, 11, 12, 16, 18)
उत्तर
1. ऑक्सीकारक गुण – गर्म करने पर सान्द्र H2SO4 अपघटित होकर ऑक्सीजन परमाणु देता है और ऑक्सीकारक का कार्य करता है।
H2SO4 → SO2 + H2O + O
(i) HBr तथा HI को क्रमश: Br2 और I2 में ऑक्सीकृत कर देता है।
- 2HBr + H2SO4 → Br2 ↑ + SO2 ↑ + 2H2O
- 2HI + H2SO4 → I2 ↑ + SO2 ↑ + 2H2O
(ii) कार्बन को CO2 में तथा सल्फर को SO2 में ऑक्सीकृत करता है।
- C + 2 H2SO4 → CO2 ↑ + 2SO2 ↑ + 2H2O
- S + 2 H2SO4 → 3SO2 ↑ + 2H2O
2. निर्जलीकारक गुण – यह कार्बनिक यौगिकों; जैसे–चीनी, फॉर्मिक अम्ल तथा ऑक्लैलिक अम्ल से जल का शोषण कर लेता है। अतः चीनी काली पड़ जाती है।

प्रश्न 14.
क्लोरीन, ब्रोमीन तथा आयोडीन के फ्लोरीन से बने किन्हीं चार अन्तरा हैलोजन यौगिकों के बनाने का रासायनिक समीकरण दीजिए। (2016)
उत्तर
अन्तरा हैलोजन यौगिक दो भिन्न हैलोजनों के सीधे संयोग द्वारा या निम्न अन्तरा हैलोजन यौगिक की हैलोजन से क्रिया द्वारा बनाए जाते हैं।
- Cl2 + F2 2ClF
- Cl2 + 3F2 (आधिक्य) 2ClF3
- Br2 + 5F2 (आधिक्य) 2BrF5
- IF5 + F2 → IF7
प्रश्न 15.
अन्तरा हैलोजन यौगिक क्या हैं? उदाहरण द्वारा समझाइए। AB3 प्रकार के क्लोरीन तथा फ्लोरीन के अन्तरा हैलोजन यौगिक बनाने का रासायनिक समीकरण लिखिए। (2014, 16)
या
ClF3 के बनाने की विधि का ताप तथा दाब की परिस्थितियों को दिखाते हुए रासायनिक समीकरण लिखिए। (2017)
उत्तर
दो भिन्न हैलोजन परमाणु X तथा X’ से बने यौगिक अन्तरा हैलोजन यौगिक कहलाते हैं। इनका सामान्य सूत्र XX’ और XX’n है। (जहाँ n = 3 से 7 तक)
IF को छोड़कर सभी XX’ प्रकार के अन्तराहैलोजन यौगिक बनाये गए हैं।
AB3 प्रकार के क्लोरीन तथा फ्लोरीन के अन्तरा हैलोजन यौगिक
Cl2 + 3F2 2ClF3
प्रश्न16.
आवर्त सारणी में अक्रिय गैसों के स्थान की विवेचना कीजिए। (2015)
उत्तर
आवर्त सारणी में अक्रिय गैसों को दायीं ओर शून्य समूह (वर्ग-18) में रखा गया है। इन तत्त्वों को इनके गुणों में समानता होने के कारण एक साथ रखा गया है। He को छोड़कर सभी अक्रिय गैसों के बाह्य कोश में 8 इलेक्ट्रॉन होते हैं। रेडॉन को छोड़कर सभी अक्रिय गैसें वायुमण्डल में मौजूद हैं। आन्तरिक और बाह्य सभी कोश पूर्ण होने के कारण ये रासायनिक रूप से निष्क्रिय होती हैं। अत: इन्हें अक्रिय गैस कहा जाता है।
दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
इलेक्ट्रॉनिक विन्यास के आधार पर नाइट्रोजन वर्ग (पाँचवे वर्ग) के तत्त्वों की आवर्त सारणी में स्थिति की विवेचना कीजिए। (2009, 10, 11, 12, 15)
उत्तर
नाइट्रोजन, फॉस्फोरस, आर्सेनिक, ऐण्टिमनी तथा बिस्मथ को आवर्त सारणी के V-A उपसमूह में रखा गया है। इन तत्त्वों को नाइट्रोजन परिवार के तत्त्व कहते हैं। इन्हें प्रायः निक्टोजन (Pnictogen) भी कहते हैं। ये तत्त्व p-ब्लॉक के तत्त्व हैं। इनका इलेक्ट्रॉनिक विन्यास निम्न प्रकार है –
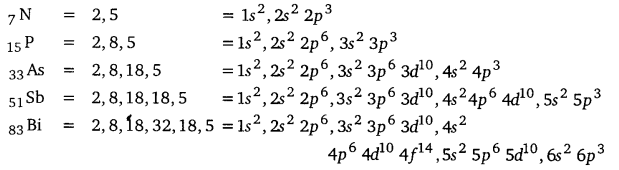
सभी तत्त्वों के बाहरी कोश में 5 इलेक्ट्रॉन हैं और बाह्यतम कोश का इलेक्ट्रॉनिक विन्यास ns2 np3 है। भीतर के सभी उपकोश पूर्ण हैं। इलेक्ट्रॉनिक विन्यास में समानता होने के कारण इनको एक ही उपसमूह में रखा जाना उचित है।
इनके गुणों में समानता तथा उनमें क्रमिक परिवर्तन तत्त्वों को एक ही उपवर्ग में रखे जाने की पुष्टि करते हैं।
गुणों में समानता
- इन तत्त्वों की मुख्य संयोजकता 3 तथा 5 है।
- ये (N2 को छोड़कर) स्वतन्त्र अवस्था में नहीं पाये जाते हैं।
- N2 के अतिरिक्त सभी ठोस हैं।
- N2 को छोड़कर सभी अपररूपता प्रदर्शित करते हैं।
- ये सभी हाइड्राइड बनाते हैं और सभी सहसंयोजक यौगिक हैं; जैसे- NH3, PH3, AsH3, SbH3 तथा BiH3.
- ये सभी बहु-परमाणुकता प्रकट करते हैं।
- ये सभी M2O3 तथा M2O5 प्रकार के ऑक्साइड बनाते हैं। नाइट्रोजन N2O, NO, NO2 प्रकार के भी ऑक्साइड बनाती है।
- ये सभी MX3 प्रकार के हैलाइड बनाते हैं, जिनका जल-अपघटन हो जाता है।
- NCl3 +3 H2O → NH3 ↑ + 3HOCl


- NCl3 +3 H2O → NH3 ↑ + 3HOCl
गुणों में क्रमिक परिवर्तन – परमाणु क्रमांक बढ़ने के साथ-साथ ऊपर से नीचे की ओर चलने पर
- परमाणु त्रिज्या तथा इलेक्ट्रॉन बन्धुता बढ़ती है।
- आयनन विभव तथा ऋण-विद्युतता घटती है।
- धात्विक लक्षण बढ़ता है।
- इनके क्वथनांक तथा घनत्व क्रमशः बढ़ते हैं।
- इनके ऑक्साइडों का अम्लीय लक्षण घटता है।
- जबकि नाइट्रोजन के ऑक्साइडों में अम्लीय प्रकृति का क्रम इस प्रकार है –
- N2O < NO < N2O3 < N2O4 < N2O5
- हाईड्राइडों का स्थायित्व घटता है, विषैलापन बढ़ता है और क्षारीय गुण घटता है, जबकि अम्लीय गुण बढ़ता है।
- इनके गलनांक व क्वथनांक NH3 से SbH3 तक घटते हैं, जबकि अपचायक क्रम इस प्रकार है –
- BiH3 > SbH3 > AsH3 > PH3
- इन सभी में sp3 -संकरण होता है और पिरेमिड ज्यामिति होती है, परन्तु बन्ध कोण NH3 से BiH तक घटता है।
- इनके ऑक्सी-अम्लों की प्रबलता घटती है।
- HNO3 > H3PO4 > H3AsO4 > H3SbO4 > H3BiO4
- इनके हैलाइडों का स्थायित्व N से Bi तक बढ़ता है तथा वाष्पशीलता घटती है। अतः ये ट्राइहैलाइड बनाते हैं।
नाइट्रोजन को छोड़कर अन्य सभी तत्त्व पेण्टाहैलाइड भी बनाते हैं।
प्रश्न 2.
हेबर विधि द्वारा अमोनिया के औद्योगिक निर्माण का नामांकित चित्र सहित वर्णन कीजिए। इसके दो प्रमुख गुण एवं दो उपयोग लिखिए। इस विधि में ला-शातेलिए नियम का क्या महत्त्व है ? (2009, 10, 11, 12, 13, 14, 15, 17)
उत्तर
हेबर विधि का सिद्धान्त–यदि शुद्ध नाइट्रोजन और हाइड्रोजन के 1 : 3 अनुपात के मिश्रण को गर्म किया जाए तो अमोनिया बनती है।
![]()
यह एक ऊष्माक्षेपी उत्क्रमणीय अभिक्रिया है और क्रिया के पश्चात् आयतन में कमी होती है, इसलिए ला-शातेलिए के नियमानुसार कम ताप और अधिक दाब पर अमोनिया अधिक उत्पन्न होगी। कम ताप पर अभिक्रिया का वेग बढ़ाने के लिए एक उत्प्रेरक प्रयोग किया जाता है। इस अभिक्रिया का उत्प्रेरक की उपस्थिति में अनुकूलतम ताप 450°-500°C तथा उच्च दाब 200 वायुमण्डल है; क्योंकि अभिक्रिया उत्क्रमणीय है, इसलिए अमोनिया को बराबर क्रिया क्षेत्र से हटाने के बाद, अमोनिया गैस अधिक बनेगी। इस अभिक्रिया में लोहे का बारीक चूर्ण (उत्प्रेरक) तथा मॉलिब्डेनम (उत्प्रेरक वर्धक) की सूक्ष्म मात्रा प्रयुक्त होती है। इसमें गैसीय मिश्रण शुद्ध होना चाहिए जिससे उत्प्रेरक विषाक्त न हो।
विधि- शुद्ध N2 तथा H2 को 1 : 3 अनुपात में मिलाकर 200 वायुमण्डल दाब पर तप्त लोहे के बारीक चूर्ण (उत्प्रेरक) को, जिसमें मॉलिब्डेनम (उत्प्रेरक वर्धक) मिला होता है, 500°C ताप पर गर्म करते हैं। इस विधि में 10 – 15% अमोनिया बनती है, जिसे संघनित्र में प्रवाहित करके द्रवित कर लेते हैं। शेष गैसों को फिर से उत्प्रेरक कक्ष में प्रवाहित करते हैं जिससे N2 व H2 के संयोजन द्वारा NH3 का लगातार उत्पादन होता रहता है।
रासायनिक गुण
1. क्षारीय गुण – यह क्षारीय गैस है तथा लाल लिटमस को नीला कर देती है। यह अम्लों से क्रिया करके लवण बनाती है।

2. धातु ऑक्साइडों का अपचयन – यह धातु ऑक्साइडों को अपचयित कर देती है।

उपयोग
- प्रयोगशाला में अभिकर्मक के रूप में।
- बर्फ बनाने तथा कोल्ड स्टोरेज में प्रशीतक के रूप में; क्योंकि इसके वाष्पन की गुप्त ऊष्मा 327 कैलोरी/ग्राम (उच्च) होती है।
प्रश्न 3.
प्रयोगशाला में नाइट्रस ऑक्साइड बनाने की विधि का सचित्र वर्णन कीजिए। नाइट्रस ऑक्साइड के दो प्रमुख रासायनिक गुण एवं दो उपयोग लिखिए। (2009, 11)
उत्तर
प्रयोगशाला में नाइट्रस ऑक्साइड (N2O) को सोडियम नाइट्रेट तथा अमोनियम सल्फेट के मिश्रण को अथवा केवल अमोनियम नाइट्रेट को गर्म करके बनाया जाता है।

अमोनियम सल्फेट व सोडियम नाइट्रेट के मिश्रण को एक गोल पेंदे के फ्लास्क में लेकर गर्म किया जाता है। इस क्रिया से N2O बनती है, जिसमें Cl2, NO व NH3 की अशुद्धियाँ होती हैं। अत: इस गैस को क्रमशः NaOH विलयन, FeSO4 विलयन व सान्द्र H2SO4 में से प्रवाहित किया जाता है जहाँ क्रमशः Cl2, NO व NH3 एवं जल-वाष्प आदि अशुद्धियाँ अवशोषित हो जाती हैं। N2O ठण्डे जल में अत्यन्त विलेय है; अतः इसे गर्म पानी के ऊपर गैस जार में एकत्रित कर लेते हैं।

रासायनिक गुण
- सोडामाइड से अभिक्रिया होने पर सोडियम ऐजाइड बनता है।
- NaNH2 + N2O → NaN3 + H2O
- KMnO4 इसको नाइट्रिक ऑक्साइड में ऑक्सीकृत कर देता है।
- N2O + [O] 2NO ↑
उपयोग
- ऑक्सीजन के साथ इसका मिश्रण दाँतों की शल्य चिकित्सा (dental surgery) में निश्चेतक (anaesthetic) के रूप में प्रयोग किया जाता है।
- सोडियम ऐजाइड बनाने में।
प्रश्न 4.
ओस्टवाल्ड विधि द्वारा नाइट्रिक अम्ल के औद्योगिक निर्माण का सचित्र वर्णन कीजिए। सम्बन्धित अभिक्रियाओं का समीकरण दीजिए। तनु नाइट्रिक अम्ल (20%) की लेड पर अभिक्रिया लिखिए। (2011, 14, 15, 16, 17)
या
अमोनिया से नाइट्रिक अम्ल के निर्माण की विधि का सचित्र वर्णन कीजिए तथा अभिक्रियाओं के रासायनिक समीकरण भी दीजिए। Cu पर इस अम्ल की क्रिया किस प्रकार होती है? यदि अम्ल (i) गर्म और सान्द्र हो (ii) ठण्डा और तनु हो। सभी अभिक्रियाओं के समीकरण लिखिए। (2009, 11, 13)
उत्तर
ओस्टवाल्ड विधि- इसमें अमोनिया गैस वायु से ऑक्सीकृत होकर नाइट्रिक ऑक्साइड बनाती है जो फिर ऑक्सीकृत होकर नाइट्रोजन डाइऑक्साइड देती है। यह जल से क्रिया करके नाइट्रिक अम्ल में परिवर्तित हो जाती है।
- 4NH3 + 5O2 4NO + 6H2O
- 2NO + O2 → 2NO2
- 3NO2 + H2O → 2HNO3 + NO ↑
शुद्ध NH3 व वायु का मिश्रण 1 : 9 के अनुपात में परिवर्तक में प्रवाहित किया जाता है। यहाँ प्लेटिनम की जाली 650° – 800°C पर गर्म रखी जाती है जो उत्प्रेरक का कार्य करती है। यहाँ NH3 का 90% भाग ऑक्सीकृत होकर नाइट्रिक ऑक्साइड बनाता है। अब गैसों का मिश्रण ऑक्सीकारक स्तम्भ में पहुँचाया जाता है, जहाँ NO ऑक्सीकृत होकर नाइट्रोजन डाइऑक्साइड देती है। NO2 अवशोषण स्तम्भ में जल में अवशोषित होकर नाइट्रिक अम्ल बनाती है।
इस प्रकार प्राप्त नाइट्रिक अम्ल तनु होता है। इसका आसवन करने पर एक निश्चित क्वथनांक का मिश्रण प्राप्त होता है, जिसे साधारण सान्द्र नाइट्रिक अम्ल कहते हैं।

तनु नाइट्रिक अम्ल की लेड पर अभिक्रिया– इस अभिक्रिया के फलस्वरूप लेड नाइट्रेट, NO व जल बनता है।

Cu पर क्रिया
- गर्म और सान्द्र HNO3 कॉपर से क्रिया करके Cu (NO3)2, N2 और जल देता है।
- 5Cu + 12HNO3 → 5Cu (NO3)2 + N2 ↑ + 6H2O
- ठण्डा और तनु HNO, कॉपर से क्रिया करके Cu(NO3)2 N2O और जल देता है।
- 4Cu + 10HNO3 → 4Cu (NO3)2 + N2O ↑ + 5H2O
प्रश्न 5.
हड्डी की राख से फॉस्फोरस प्राप्त करने की आधुनिक विधि का वर्णन कीजिए। फॉस्फोरस से फॉस्फीन गैस कैसे बनाओगे? (2009, 10, 11)
उत्तर
हड्डियों की राख या खनिज कैल्सियम फॉस्फेट [Ca3(PO4)2] को कोक एवं रेत के साथ मिलाकर हॉपर मार्ग से पेचदार चालक की सहायता से विद्युत भट्ठी में गिराते हैं। इस भट्ठी में दो कार्बन इलेक्ट्रोड होते हैं जिनके बीच विद्युत आर्क उत्पन्न किया जाता है। जिसके फलस्वरूप 1500°C ताप उत्पन्न हो जाता है। सर्वप्रथम कैल्सियम फॉस्फेट [Ca3(PO4)2], रेत (SiO2) के साथ क्रिया कर कैल्सियम सिलिकेट (CaSiO3) और फॉस्फोरस पेन्टॉक्साइड (P2O5) बनाता है। फिर P2O5 कार्बन द्वारा अपचयित होकर फॉस्फोरस की वाष्प देता है। यह वाष्प ऊपर के द्वार से निकलकर जल में ठोस रूप में एकत्रित हो जाती है। कैल्सियम सिलिकेट (धातुमल) नीचे के द्वार से निकाल लिया जाता है।

2P2O5 + 10C → P4 + 10CO ↑
शुद्धिकरण– इस प्रकार प्राप्त फॉस्फोरस में कुछ अशुद्धियाँ होती हैं। इनको पृथक् करने के लिए एक टैंक में अशुद्ध फॉस्फोरस को क्रोमिक अम्ल (K2Cr2O7 + सान्द्र H2SO4) में डालकर पिघलाते हैं। इससे अशुद्धियाँ ऑक्सीकृत होकर मल के रूप में द्रव के ऊपर तैरने लगती हैं और फॉस्फोरस एक निर्मल और रंगहीन द्रव के रूप में टैंक के पेंदे में बैठ जाता है। पिघले हुए फॉस्फोरस को एक लम्बी नली में से प्रवाहित करते हैं जिसमें वह ठण्डा होकर जम जाता है। नली में जल डालकर ठोस फॉस्फोरस को जल में एकत्रित करते हैं।
फॉस्फोरस से फॉस्फीन गैस बनाना – फॉस्फोरस को निष्क्रिय वातावरण में NaOH के सान्द्र विलयन के साथ गर्म करने पर फॉस्फीन गैस बनती है।

प्रश्न 6.
इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में ऑक्सीजन एवं सल्फर तत्त्वों की स्थिति की विवेचना कीजिए। (2010)
या
इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में ऑक्सीजन परिवार (VI-A वर्ग के तत्त्वों) के तत्त्वों की स्थिति की विवेचना कीजिए। (2012)
उत्तर
मेंडलीव की आवर्त सारणी के VI-A समूह में पाँच तत्त्व हैं। तत्त्वों का यह परिवार ‘ऑक्सीजन परिवार’ कहलाता है। इस समूह के प्रथम चार तत्त्वों को सामूहिक रूप में ‘कैल्कोजन’ (chalcogen) के रूप में पुकारा जाता है। इस समूह में परमाणु भार की वृद्धि के साथ धात्विक या धन विद्युतीय गुण बढ़ता है तथा घनत्व, क्वथनांक और गलनांक में वृद्धि होती है। इस समूह में O, S अधातु हैं, जबकि Se व Te उपधातुएँ हैं और Po धातु है।
रासायनिक गुणों में ऑक्सीजन, परिवार के अन्य तत्त्वों से भिन्न है, परन्तु अन्य सभी तत्त्वों के गुणों में समानता पाई जाती है।
- 1. ऑक्सीजन, सल्फर व सेलीनियम परमाणु के बाह्यतम संयोजी कक्ष में 6 इलेक्ट्रॉन हैं।

अतः इन तीनों तत्त्वों के परमाणु रासायनिक अभिक्रिया में अन्य परमाणुओं से 2 इलेक्ट्रॉन लेकर अथवा 2 इलेक्ट्रॉन के जोड़े साझा करके अपनी बाह्यतम कक्ष में अधिकतम इलेक्ट्रॉन (8) प्राप्त करने हेतु संयोग करते हैं। - तीनों ही अधातु हैं (Se धात्विक गुण भी रखती है) जो प्रकृति में स्वतन्त्र व संयुक्त अवस्था में पाये जाते है।
- तीनों समान यौगिक बनाते हैं।
- CO2, H2O, P2O5, As2O5,
- SO2, H2S, P2S5, As2S5,
- SeO2, H2Se, P2Se3,
- C2H2OH तथा C2H2SH; C2H2-O-C2H5 तथा C2H5-S-C2H5
- तीनों ही हाइड्रोजन के साथ संयोग कर लेते हैं।
- H2O, H2S, H2S3, H2Se,
- H2O2, H2S2, H2S4
- तीनों ही RO2 प्रकार के ऑक्साइड बनाते हैं; जैसे- O3,SO2, SeO2 आदि। O3 ऑक्सीजन का ऑक्साइड माना जाता है।
- तीनों ही कार्बन के साथ संयोग करके क्रमश: CO2, CS2 व CSe2 बनाते हैं।
- तीनों ही अपररूपती प्रदर्शित करते हैं।
- तीनों तत्त्व ऑक्सीजन, सल्फर व सेलीनियम शृंखलन गुण भी व्यक्त करते हैं।
- धातु से क्रिया– ये Na, Cu, Zn, Fe आदि धातुओं के साथ क्रिया करके क्रमश: ऑक्साइड, सल्फाइड व सेलिनाइड बनाते हैं।
- ऑक्साइड व ऑक्सी अम्ल– ये तत्त्व ऑक्सीजन से संयोग करके डाई ऑक्साइड बनाते हैं। (सल्फर ट्राइ ऑक्साइड) भी बनाते हैं; जैसे- SO2, SeO2 आदि। ये जल में घुलकर ऑक्सी अम्ल बनाते हैं।
- SO2 + H2 → H2SO3
- SeO2 + H2O → H2SeO3
इनकी प्रबलता का क्रम H2SO3 > H2SeO3 है।
अतः स्पष्ट है कि ऑक्सीजन, सल्फर व सेलीनियम तीनों को ही आवर्त सारणी के षष्ठम् समूह में एक साथ रखना औचित्यपूर्ण है।
प्रश्न 7.
शुद्ध ओजोन किस प्रकार प्राप्त करते हैं? Sncl2, FeSO2 और KI के साथ इसकी अभिक्रियाएँ लिखिए। (2009, 11, 14)
या
ओजोन बनाने की प्रयोगशाला विधि का वर्णन कीजिए। प्रयुक्त उपकरण का नामांकित रेखाचित्र दीजिए तथा इसके दो ऑक्सीकारक गुण दीजिए। समीकरण भी लिखिए। (2011, 13)
या
ब्रॉडी के ओजोनाइजर द्वारा ओजोन बनाने की विधि का सचित्र वर्णन कीजिए। इसके दो मुख्य उपयोग भी लिखिए। (2009)
या
ब्रॉडी ओजोनाइजर का नामांकित चित्र बनाइए। (2018)
उत्तर
प्रयोगशाला में ओजोन, ऑक्सीजन के नीरव विद्युत विसर्जन विधि द्वारा प्राप्त की जाती है।
3O2 → 2O3 ↑
नीरव विद्युत विसर्जन के लिए सीमेन्स का ओजोनाइजर या ब्रॉडी का ओजोनाइजर प्रयोग किया जाता है।
ब्रॉडी का ओजोनाइजर – यह एक U आकार की नली का बना होता है जिसका एक सिरा काफी चौड़ा होता है। इस सिरे में एक पतली परखनली को डालकर ऊपर वाले भाग को बन्द कर दिया जाता है। परखनली में तनु H2SO4 भरा होता है और उसमें एक प्लेटिनम का तार लटका देते हैं। सारे उपकरण को तनु H2SO4 में रखते हैं। इस बर्तन में भी एक प्लेटिनम का तार लटका देते हैं। प्लेटिनम के दोनों इलेक्ट्रोडों को चित्रानुसार प्रेरण कुण्डली से जोड़ देते हैं। नली में शुष्क ऑक्सीजन प्रवाहित करते हैं, जिससे 25% ओजोन प्राप्त होती है।

ऑक्सीकारक गुण
- 1. यह स्टेनस क्लोराइड को तनु HCl की उपस्थिति में स्टेनिक क्लोराइड में ऑक्सीकृत कर देती है।
- 3SnCl2 +6HCl +O3 → 3SnCl4 +3H2O
- 2. यह फेरस सल्फेट को तनु H2SO4 की उपस्थिति में फेरिक सल्फेट में ऑक्सीकृत कर देती है।
- 2FeSO2 + O3 + H2SO4 → Fe2(SO4)3 + H2O + O2
- KI विलयन में प्रवाहित करने पर I2 में ऑक्सीकृत कर देती है।
- 2KI + H2O + O3 → 2KOH + I2 ↑ + O2 ↑
उपयोग
- प्रबल ऑक्सीकारक के रूप में।
- जीवाणुनाशक के रूप में।
प्रश्न 8.
इलेक्ट्रॉनिक विन्यास के आधार पर क्लोरीन, ब्रोमीन एवं आयोडीन की आवर्त सारणी में स्थिति स्पष्ट कीजिए (2010)
या
इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में हैलोजनों की स्थिति की विवेचना कीजिए। (2010, 12)
उत्तर
क्लोरीन, ब्रोमीन, आयोडीन को फ्लोरीन तथा ऐस्टैटीन के साथ आवर्त सारणी के VIIA उप-समूह में रखा गया है। VIIA के प्रथम चार तत्त्वों (F, CI, Br, I) को हैलोजन कहते हैं। ‘हैलोजन’ शब्द की उत्पत्ति दो ग्रीक शब्दों ‘हैल्स’ (Hals) तथा ‘जेन्स’ (Genes) से हुई है, जिसका अर्थ है-समुद्री लवण पैदा करने वाला। ये सभी तत्त्वे अपने लवण के रूप में समुद्री जल में पाये जाते हैं। इनके इलेक्ट्रॉनिक विन्यास इस प्रकार हैं –

इन सभी तत्त्वों के बाहरी कोश में 7 इलेक्ट्रॉन होते हैं और बाहरी कोश का इलेक्ट्रॉनिक विन्यास ns2 np5 है तथा भीतर के सभी कोश पूर्ण हैं। इलेक्ट्रॉनिक विन्यास में समानता होने के कारण इनके गुणों में समानता है और उनमें क्रमिक परिवर्तन पाया जाता है।
गुणों में समानता
- ये वैद्युत संयोजकता (-1) तथा सह-संयोजकता दोनों ही प्रकट करते हैं।
- इनकी वाष्प रंगीन तथा तीक्ष्ण गन्ध वाली होती है।
- गैसीय अवस्था में ये द्वि-परमाणुक होते हैं।
- सभी प्रारूपिक अधातु हैं।
- हाइड्रोजन से सीधा संयोग कर हाइड्रो अम्ल बनाते हैं; जैसे- HCl, HBr, HI
- इनकी धातुएँ वाष्प में जलकर हैलाइड बनाती हैं।
- 2Na + Cl2 → 2NaCl
- Mg + Br2 → MgBr2
- Cl2 तथा Br2 जल के साथ क्रिया कर O2 निकालती है।
- 2Cl2 + 2H2O → 4HCl + O2
- Cl2, Br2,I2, ऑक्सीकारक के रूप में प्रयुक्त होते हैं।
- ये तत्त्व वैद्युत तथा ऊष्मा के कुचालक होते हैं।
- क्षारों के साथ समान रूप से क्रिया करते हैं।
- सभी प्रबल ऑक्सीकारक हैं।
- H2S + Cl2 → 2HCl + S
- SO2 + Cl2 + 2H2O → 2HCl + H2SO4
- सभी अम्लीय ऑक्साइड बनाते हैं।
गुणों में क्रमिक परिवर्तन – परमाणु संरचना तथा गुणों की समानता से स्पष्ट है कि इन तत्त्वों को एक ही समूह में रखना न्यायोचित है। इसके अतिरिक्त तत्त्वों के गुणों में श्रेणीबद्ध परिवर्तन परमाणु क्रमांक के परिवर्तन पर निर्भर करता है तथा किसी समूह में तत्त्वों की विभिन्न स्थानों पर स्थिति का निर्णायक भी है। इन तत्त्वों के गुणों में परमाणु क्रमांक बढ़ने पर श्रेणीबद्ध परिवर्तन इस प्रकार हैं –
- तत्त्वों की अवस्था में क्रमिक परिवर्तन होता है; जैसे- क्लोरीन गैस है, ब्रोमीन द्रव तथा आयोडीन ठोस है।
- गैसों का रंग गहरा होता जाता है। अत: फ्लोरीन हल्की पीली है, क्लोरीन हरी-पीली, ब्रोमीन लाल-भूरी तथा आयोडीन वाष्प गहरी बैंगनी है।
- इनकी क्रियाशीलता घटती है।
- इनका ऑक्सीकारक स्वभाव भी घटता है।
- क्वथनांक बढ़ते हैं तथा आपेक्षिक ताप घटते हैं।
- परमाणु त्रिज्याएँ बढ़ती हैं।
- आयनन विभव घटते हैं।
इन तत्त्वों के गुणों में समानता तथा परमाणु क्रमांक में क्रमिक वृद्धि के साथ गुणों में श्रेणीबद्ध परिवर्तन इस बात का निर्णायक है कि ये तत्त्व एक समूह में रखे जाने चाहिए। इनके परमाणुओं के बाहरी कोश की ns2 np5 संरचना सह इंगित करती है कि इनकी सातवें समूह में स्थिति न्यायोचित है।
प्रश्न 9.
डीकन विधि द्वारा क्लोरीन के निर्माण का सचित्र वर्णन कीजिए। यह निम्नलिखित से किस प्रकार की क्रिया करती है? (2015)
(i) सोडियम आर्सेनाइट विलयन, (ii) गर्म चूने का पानी।
या
डीकन विधि द्वारा क्लोरीन के औद्योगिक निर्माण का सचित्र वर्णन कीजिए। इसकी अमोनिया के साथ अभिक्रिया लिखिए। आवश्यक रासायनिक समीकरण भी लिखिए। (2013, 15, 16, 18)
या
क्लोरीन के एक ऑक्सीकारक गुण का रासायनिक समीकरण दीजिए।
उत्तर
क्लोरीन के औद्योगिक निर्माण की निम्नलिखित तीन विधियाँ हैं-
- वेल्डन विधि
- डीकन विधि तथा
- वैद्युत-अपघटनी विधि।
डीकन विधि या HCl से क्लोरीन के निर्माण की विधि – इस विधि में HCl का ऑक्सीकरण क्यूप्रस क्लोराइड (उत्प्रेरक) की उपस्थिति में वायु की ऑक्सीजन द्वारा निम्न प्रकार किया जाता है –

4HCl + O2 2H2O +2Cl2 ↑
उत्प्रेरक कक्ष में झाँबा पत्थर क्यूप्रस क्लोराइड विलयन में भिगोकर रख देते हैं तथा ताप 450°C कर देते हैं। HCl तथा वायु का मिश्रण 4 : 1 के अनुपात में लेकर उत्प्रेरक कक्ष में प्रवाहित किया जाता है। यहाँ क्लोरीन बनती है, पर इसमें HCl, N2,O2 तथा जल-वाष्प मिले होते हैं। इस मिश्रण को स्क्रबर में प्रवाहित करके HCl हटा देते हैं। दूसरे कक्ष में प्रवाहित करने पर सान्द्र H2SO4 द्वारा जल-वाष्प पृथक् कर देते हैं। इस प्रकार N2,O2 मिश्रित क्लोरीन प्राप्त होती है।
उत्प्रेरक की क्रिया निम्न प्रकार होती है –
- 2Cu2Cl2 + O2 → 2Cu2OCl2
- 2HCl + Cu2OCl2 → 2CuCl2 + H2O
- 2CuCl2 → Cu2Cl2 + Cl2 ↑
क्रियाएँ
- यह सोडियम आर्सेनाईट को सोडियम आर्सिनेट में ऑक्सीकृत कर देती है।
- Na3AsO3 + H2O + Cl2 → Na3AsO4 +2HCl
- क्लोरीन गर्म चूने के पानी के साथ कैल्सियम क्लोराइड तथा कैल्सियम क्लोरेट बनाती है।
- 6Ca(OH)2 + 6Cl2 → 5CaCl2 + Ca(ClO3)2 + 6H2O
ऑक्सीकारक गुण – यह H2S को सल्फर में ऑक्सीकृत कर देती है।
H2S + Cl2 → 2HCl + S ↓
NH3 से अभिक्रिया
NH3 + 3Cl2 → NCl3 + 3HCl
प्रश्न10.
प्रयोगशाला में हाइड्रोक्लोरिक अम्ल के विरचन की विधि, प्रमुख रासायनिक गुण तथा उपयोग का वर्णन कीजिए। (2017)
उत्तर
हाइड्रोक्लोरिक अम्ल के विरचन की प्रयोगशाला विधि – प्रयोगशाला में हाइड्रोजन क्लाराइड गैस सोडियम क्लोराइड (नमक) को सान्द्र H2SO4 के सार्थ गर्म करके बनाई जाती है।

हाइड्रोजन क्लोराइड गैस को जल में अवशोषित करने पर हाइड्रोक्लोरिक अम्ल प्राप्त होता है। हाइड्रोजन क्लोराइड गैस के जलीय विलयन को हाइड्रोक्लोरिक अम्ल कहते हैं।
हाइड्रोजन क्लोराइड गैस एवं हाइड्रोक्लोरिक अम्ल बनाने में प्रयुक्त उपकरण संलग्न चित्र में प्रदर्शित है।
1. हाइड्रोजन क्लोराइड गैस बनाने की विधि – एक गोल पेंदे के फ्लास्क में कुछ सोडियम क्लोराईड (ठोस) लो और थिसेल फनल द्वारा सावधानी से सान्द्र सल्फ्यूरिक अम्ल फ्लास्क में डालो जिससे फनल का निचला सिरा अम्ल में डूब जाए। फ्लास्क को गर्म करो। गर्म करने पर हाइड्रोजन क्लोराइड गैस बनती हैं और निकास नली से बाहर निकलने लगती है। गैस को वायु के उपरिमुखी विस्थापन द्वारा एक गैस जार में एकत्रित कर लो।। शुष्क HCl गैस प्राप्त करने के लिए निकास नली को सान्द्र H2SO4 की बोतल से जोड़ दो जिससे कि नम HCl गैस सान्द्र H2SO4 में से प्रवाहित होकर शुष्क हो जाए। सान्द्र H2SO4 युक्त बोतल में लगी दूसरी निकास नली से निकल रही शुष्क HCl गैस को अब जार में एकत्रित कर लो।

2. हाइड्रोजन क्लोराइड गैस से हाइड्रोक्लोरिक अम्ल बनाने की विधि – चित्र में प्रदर्शित फ्लास्क में लगी हुई निकास नली के बाहर निचले सिरे पर रबर की नली के द्वारा एक साधारण फनल (छोटे स्तम्भ की) जोड़ दो। फनल का कुछ भाग एक पात्र में भरे जल में डुबा दो। निकास नली से फनल के द्वारा HCl गैस जल में पहुँचेगी और जल में विलेय हो जाएगी। इस प्रकार HCl गैस का जलीय विलयन अर्थात् हाइड्रोक्लोरिक अम्ल बन जाएगा।
रासायनिक गुण
1. धातुओं से क्रिया – कॉपर, मरकरी, सिल्वर, गोल्ड और प्लैटिनम धातुओं को छोड़कर लगभग सभी धातुएँ हाइड्रोक्लोरिक अम्ल से क्रिया करती हैं। क्रिया में धातु क्लोराइड बनता है और हाइड्रोजन गैस निकलती है।
- 2Na + 2HCl → 2NaCl + H2
- Mg + 2HCl → MgCl2 + H2
- Zn + 2HCl → ZnCl2 + H2
- Fe + 2HCl → FeCl2 + H2
- 2Al + 6HCl → 2AlCl2 + 3H2
सान्द्र हाइड्रोक्लोरिक अम्ल और सान्द्र नाइट्रिक अम्ल के आयतन से 3 : 1 मिश्रण को ‘ऐक्वारेजिया’ (aquaregia) कहते हैं। इस मिश्रण में गोल्ड (Au), प्लेटिनम (Pt) आदि धातुएँ घुल जाती हैं।
3HCl + HNO3 → NOCl + Cl2 + 2H2O
Au + Cl2 + NOCl → AuCl3 + NO

2. क्षारों से क्रिया – क्षार और अम्ल के परस्पर क्रिया करने से लवण और जल बनता है। इस क्रिया को उदासीनीकरण कहते हैं।
- NaOH + HCl → NaCl + H2O
- Ba(OH)2 + 2HCl → BaCl + 2H2O
3. धातु ऑक्साइडों से क्रिया – धातु ऑक्साइड और अम्ल की परस्पर क्रिया कराने पर लवण और जल बनता है।
- MgO + 2HCl → MgCl2 + H2O
- CuO + 2HCl → CuCl2 + H2O
- ZnO + 2HCl → ZnCl2 + H2O
4. अमोनिया से क्रिया – अमोनिया और HCl गैस की परस्पर क्रिया से अमोनियम क्लोराइड के सफेद धूम (fumes) बनते हैं।

अमोनियम के जलीय विलयन की HCl विलयन से क्रिया कराने पर अमोनियम क्लोराइड और जल बनता है।
NH4OH + HCl → NH4Cl+ H2O
5. धातु कार्बोनेट से क्रिया – धातु कार्बोनेट की हाइड्रोक्लोरिक अम्ल से क्रिया कराने पर लवण, जल और कार्बन डाइऑक्साइड बनते हैं।
- Na2CO3 + 2HCl → 2NaCl + H2O + CO2
- CaCO3 + 2HCl → CaCl2 + H2O + CO2
उपयोग
- धातुओं के क्लोराइड बनाने में।
- अम्ल के रूप में।
- ऐक्वारेजिया (आयतन से 1 भाग सान्द्र HNO3 +3 भाग सान्द्र HCl) बनाने में।
- क्लोरीन गैस बनाने में।
- गाई, चमड़े और अन्य उद्योगों में।
प्रश्न 11.
विरंजक चूर्ण क्या है? विरंजक चूर्ण के निर्माण की विधि का वर्णन नामांकित चित्र के साथ कीजिए तथा इसका एक ऑक्सीकारक गुण भी लिखिए। (2016)
उत्तर
यह एक मिश्रित लवण है जिसको कैल्सियम क्लोरोहाइपोक्लोराइट भी कहते हैं। विरंजक चूर्ण के एक अणु में एक कैल्सियम आयन (Ca2+), एक क्लोराइड आयन (Cl–) तथा एक हाइपोक्लोराइट आयन (OCl–) होते हैं, जिसको Ca2+ (Cl–) (OCl–) रूप में भी व्यक्त कर सकते हैं। विरंजक चूर्ण का निर्माण बैचमान विधि द्वारा किया जाता है। इसके अन्तर्गत शुष्क बुझे हुए चूने पर क्लोरीन की अभिक्रिया करायी जाती है।

विधि- यह विधि विरंजक चूर्ण (CaOCl2) बनाने की आधुनिक विधि है। इसमें लोहे का बना हुआ एक टॉवर होता है जिसमें खाने बने होते हैं। संयंत्र के ऊपरी भाग से हॉपर द्वारा बुझा हुआ चूना [Ca(OH2)] डाला जाता है। टॉवर में नीचे से गर्म वायु और क्लोरीन की धारा प्रवाहित की जाती है। Ca(OH)2 व Cl2 गैस की क्रिया से विरंजक चूर्ण बनता है, जिसे संयंत्र के निचले भाग से बाहर निकाल लेते हैं। व्यर्थ गैसें संयंत्र के ऊपरी भाग से बाहर निकल जाती हैं।
ऑक्सीकारक गुण – यह तनु अम्ल की अभिक्रिया से ऑक्सीजन देता है, अत: यह एक ऑक्सीकारक है।
- यह PbO को PbO2 में ऑक्सीकृत कर देता है।
- 2CaOCl2 + 2PbO → 2CaCl2 + 2PbO2
- यह PbO को PbO2 में ऑक्सीकृत कर देता है।
- यह अम्लीय माध्यम में KI को I2 में ऑक्सीकृत कर देता है।
- CaOCl2 + 2CH3COOH + 2KI → (CH3COO)2Ca + 2KCl + I2 ↑ + H2O