UP Board Solutions for Class 8 Science Chapter 4 खनिज एवं धातु
These Solutions are part of UP Board Solutions for Class 8 Science. Here we have given UP Board Solutions for Class 8 Science Chapter 4 खनिज एवं धातु.
खनिज एवं धातु
अभ्यास प्रश्न
प्रश्न 1.
निम्नलिखित प्रश्नों में सही विकल्प अँटकर अपनी अभ्यास-पुस्तिका में लिखिए (लिखकर) –
उत्तर
(क) निम्नलिखित वस्तुओं में कौन-सी वस्तु संक्षारित हो सकती है –
(अ) लकड़ी की मेज।
(ब) स्टील की कुर्सी
(स) खुली स्थानों पर रखी लोहे की छड़ ✓
(द) तेल लेपित लोहे की छड़
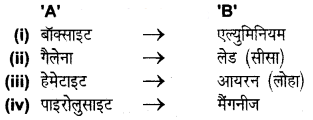
(ख) बॉक्साइट किसका अयस्क है –
(अ) सोडियम
(ब) लोहा
(स) एल्युमिनियम ✓
(द) कॉपर
(ग) इनमें से कौन सी सान्द्रण की विधि नहीं है?
(अ) फेन प्लावन विधि,
(ब) चुम्बकीय पृथक्करण
(स) निस्तापन ✓
(द) गुरुत्वीय पृथक्करण
प्रश्न 2.
रिक्त स्थानों की पूर्ति कीजिए (पूर्ति करके) –
उत्तर
(क) सोडियम धातु को मिट्टी के तेल में रखते हैं।
(ख) जंग लगने के लिए ऑक्सीजन तथा नमी आवश्यक है।
(ग) धातु से तार बनाने का गुण तन्यता कहलाता है।
(घ) जिन खनिजों से धातु का निष्कर्षण किया जाता है, उन्हें अयस्क कहते हैं।
प्रश्न 3.
निम्नलिखित कथनों में सही कथन पर (✓) तथा गलत कथन पर (✗) का चिह्न लगाइए (लगाकर)-
उत्तर

प्रश्न 4.
कॉलम ‘A’ के शब्दों को कॉलम ‘B’ के शब्दों से सही मिलान कीजिए (मिलान करके) –
उत्तर
प्रश्न 5.
निम्नलिखित प्रश्नों का संक्षिप्त उत्तर दीजिए
(क) खनिज तथा अयस्क में क्या अन्तर है?
उत्तर
खनिज वह पदार्थ है, जिसे जमीन के अन्दर खुदाई करके प्राप्त किया जाता है, परन्तु जिन खनिजों से धातुओं का निष्कर्षण सरलतापूर्वक किया जाता है, उन्हें अयस्क कहते हैं।
(ख) धातुकर्म से क्या समझते हैं?
उत्तर
धातुकर्म – किसी अयस्क से धातु की प्राप्ति तथा उसके शुद्धिकरण की विधि को धातुकर्म कहते हैं।
(ग) धातुओं की अघातवर्धनीयता तथा तन्यता के गुण का क्या अर्थ है? ।
उत्तर
धातुओं को पीटकर चादरों के रूप में परिवर्तित करने के गुण को अघातवर्धनीयता कहते हैं। तथा धातुओं को खींचकर तार के रूप में परिवर्तित करने के गुण को तन्यता कहते हैं।
(घ) धातुओं का संक्षारण क्या है?
उत्तर
कुछ धातुओं को नम हवा में रखने अथवा वर्षा ऋतु में पानी में पड़े रहने पर उनकी सतह पर एक प्रकार की भूरे रंग की तह (जंग या लेप) जम जाती है। इस प्रकार धातु कमजोर होती जाती है। इस क्रिया को धातु का संक्षारण कहते हैं। लोहे के ऊपर भूरे रंग की जंग लगना तथा जस्ते के ऊपर सफेद रंग की जंग लगना इसके उदाहरण हैं।
(ङ) मुक्त अवस्था में पाए जाने वाले किन्हीं दो धातुओं के नाम लिखिए।
उत्तर
सोना तथा चाँदी ।।
(च) मिश्र धातु क्या होती हैं?
उत्तर
दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्र धातु कहते हैं। ये धातुओं को उनकी पिघली हुई अवस्था में मिलाने पर बनती हैं। |
(छ) खनिज तथा अयस्क में क्या अन्तर है?
उत्तर
खनिज- जो पदार्थ पृथ्वी के धरातल से खोदकर निकाले जाते हैं। उन्हें खनिज कहते हैं। उदाहरणलोहा, अभ्रक, कोयला आदि।
अयस्क-ऐसे खनिज, जिनसे धातु का निष्कर्षण अधिक मात्रा में सरलता से एवं कम लागत में हो जाता है। अयसक (ore) कहलाते हैं।
उदाहरण- बॉक्साइड, जिप्सम, कैलेमान ।
(ज) किसी एक द्रव धातु का नाम लिखिए।
उत्तर
पारा
प्रश्न 6.
निम्नलिखित प्रश्नों का उत्तर दीजिए-
(क) धातुओं की ऑक्सीजन से अभिक्रिया को उदाहरण सहित स्पष्ट कीजिए।
उत्तर
धातु ऑक्सीजन के साथ क्रिया करके धातु ऑक्साइड बनाते हैं, उदाहरण –
(i) सोडियम कमरे के सामान्य ताप पर ऑक्सीजन से क्रिया करके सोडियम ऑक्साइड बनाता है।
4Na +O2 → 2Na2O
(ii) मैग्नीशियम का तार ऑक्सीजन की उपस्थिति में जलकर मैग्नीशियम ऑक्साइड (सफेद पाउडर) बनाता है।
2Mg +O2 → 2MgO
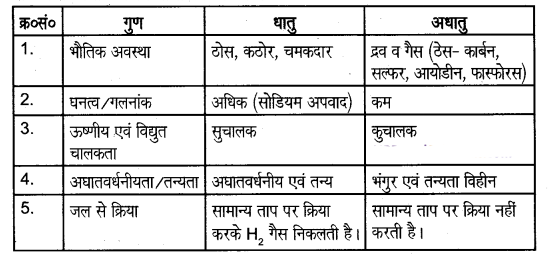
(ख) धातु तथा अधातु की जल से क्रिया लिखिये।
उत्तर
धातु-जल से सामान्य ताप पर क्रिया करके H2 गैस निकालती है।
अधातु-जल से सामान्य ताप पर क्रिया नहीं करती।
(ग) लोहा, ताँबा तथा सोने के अयस्क देश में कहाँ पाये जाते हैं।
उत्तर
लोहा- बिहार, उड़ीसा, मध्य प्रदेश, तमिलनाडू, कर्नाटक, छत्तीसगढ़। |
ताँम्बा- आंध्र प्रदेश, बिहार, राजस्थान, मध्य प्रदेश।
सोने- (कोलार खान-कर्नाटक), आन्ध्र प्रदेश।
(घ) धातुओं की जल के साथ अभिक्रिया को दो उदाहरण द्वारा स्पष्ट कीजिए। |
उत्तर
धातु जल के साथ क्रिया करके धातु हाइड्रॉक्साइड/ऑक्साइड तथा हाइड्रोजन गैस बनाते हैं। उदाहरण –
(i) सोडियम धातु जल के साथ तीव्र गति से अभिक्रिया करके सोडियम हाइड्रॉक्साइड तथा” हाइड्रोजन गैस बनाता है।
2Na + 2H2O → 2NaOH + H2
(ii) मैग्नीशियम भाप या गर्म पानी के साथ क्रिया करके मैग्नीशियम ऑक्साइड तथा हाइड्रोजन गैस बनाता है।
Mg + H2O → MgO + H2
(ङ) सोडियम धातु का जल तथा ऑक्सीजन से क्रिया का रासायनिक समीकरण लिखिए।
उत्तर
सोडियम धातु की जल के साथ क्रिया – सोडियम धातु जल के साथ तीव्र गति से अभिक्रिया करके सोडियम हाइड्रॉक्साइड तथा हाइड्रोजन गैस बनाता है।
2Na + 2H2O → 2NaOH + H2
सोडियम धातु की ऑक्सीजन के साथ क्रिया – सोडियम कमरे के सामान्य ताप पर ऑक्सीजन से क्रिया करके सोडियम ऑक्साईड बनाता है।
4Na + O2 → 2Na2O
(च) धातु तथा अधातु में अन्तर स्पष्ट कीजिए।
उत्तर
थातु तथा अधातु में निम्नलिखित अन्तर है-
(छ) धातु के संक्षारण की रोकथाम के लिए अपनाई जाने वाली विभिन्न विधियों का वर्णन कीजिए।
उत्तर
धातु के संक्षारण की रोकथाम की विभिन्न विधियाँ निम्नलिखित हैं –
- पेंट का लेप चढ़ाकर – धातु की वस्तुओं की सतह पर पेंट लगाकर उसे क्षरण से बचाया जा सकता है। इसी कारण लोहे के फर्नीचर, लोहे के पुल, रेल के डिब्बे, बस, ट्रक आदि को पेंट किया जाता है।
- ग्रीस या तेल लगाकर – नए औजारों जैसे – कैंची, चाकू, मशीन आदि पर ग्रीस या तेल लगाकर उन्हें क्षरण से बचाया जा सकता है।
- गैल्वोनीकरण (धातु चढ़ाना) – लोहा को जंग से बचाने के लिए लोहे की चादर या अन्य पात्र को पिघले हुए जस्ते में डुबा देते हैं, जिसके कारण लोहे पर जस्ते की एक पतली परत जम जाती है। इस लोहे का उपयोग बाल्टी, टंकी आदि बनाने में किया जाता है।
- इलेक्ट्रोप्लेटिंग (विद्युत लेपन) – कुछ धातु जैसे क्रोमियम, निकिल तथा टिन वायुमण्डल में उपस्थित ऑक्सीजन एवं नमी से प्रभावित नहीं होते हैं। लोहे का क्षरण रोकने के लिए उसके चारों ओर क्रोमियम या टिन की इलेक्ट्रोप्लेटिंग की जाती है। एल्युमिनियम को क्षरण से बचाने के लिए उसके ऊपर एल्युमिनियम ऑक्साइड का विद्युत लेपन कर दिया जाता है।
- मिश्र धातु बनाकर – कभी-कभी एक धातु में दूसरी धातु या अधातु मिलाने पर वह अधिक कठोर, स्थायी तथा संक्षारण से सुरक्षित हो जाता है। स्टील, लोहा तथा कार्बन का मिश्रण मिश्र धातु है, जिसमें आसानी से जंग नहीं लगता है।
(ज) तवे की हैंडल में लकड़ी लगी होती है, क्यों?
उत्तर
लकड़ी ताप का कुचालक है। इसके पकड़ने से हाथ नहीं जलता। इसलिए तवे की हैंडल में लकड़ी लगी होती है।
● नोट- प्रोजेक्ट कार्य छात्र स्वयं करें।
We hope the UP Board Solutions for Class 8 Science Chapter 4 खनिज एवं धातु help you. If you have any query regarding UP Board Solutions for Class 8 Science Chapter 4 खनिज एवं धातु, drop a comment below and we will get back to you at the earliest.