UP Board Solutions for Class 11 Chemistry Chapter 6 Thermodynamics (ऊष्मागतिकी)
These Solutions are part of UP Board Solutions for Class 11 Chemistry. Here we have given UP Board Solutions for Class 11 Chemistry Chapter 6 Thermodynamics (ऊष्मागतिकी).
पाठ के अन्तर्गत दिए गए प्रश्नोत्तर
सही उत्तर चुनिए-
प्रश्न 1.
ऊष्मागतिकी अवस्था फलन एक राशि है
(i) जो ऊष्मा परिवर्तन के लिए प्रयुक्त होती है।
(ii) जिसका मान पथ पर निर्भर नहीं करता है।
(iii) जो दाब-आयतन कार्य की गणना करने में प्रयुक्त होती है।
(iv) जिसका मान केवल ताप पर निर्भर करता है।
उत्तर
(ii) जिसका मान पथ पर निर्भर नहीं करता है।
प्रश्न 2.
एक प्रक्रम के रुद्रोष्म परिस्थितियों में होने के लिए-
(i) ∆T = 0
(ii) ∆p = 0
(iii) q = 0
(iv) w = 0
उत्तर
(iii) q= 0
प्रश्न 3.
सभी तत्वों की एन्चैल्पी उनकी सन्दर्भ-अवस्था में होती है-
(i) इकाई
(ii) शून्य
(iii) <0
(iv) सभी तत्त्वों के लिए भिन्न होती है।
उत्तर
(ii) शून्य।
प्रश्न 4.
मेथेन के दहन के लिए AU° का मान -X kJ mol-1 है। इसके लिए ∆H⊖ का मान होगा
(i) = ∆U⊖
(ii) >∆U⊖
(iii) <∆U⊖
(iv) = 0
उत्तर
मेथेन के दहन के लिए सन्तुलित समीकरण होगी-

प्रश्न 5.
मेथेन, ग्रेफाइट एवं डाइहाइड्रोजन के लिए 298 K पर दहन एन्थैल्पी के मान क्रमशः -890.3 kJ mol-1,-393.5 kJ mol-1 एवं -285.8 kJ mol-1 हैं। CH4(g) की विरचन एन्थैल्पी क्या होगी?
(i) -74.8 kJ mol-1
(ii)-52.27 kJ mol-1
(iii) +74.8 kJ mol-1
(iv) +52.26 kJ mol-1
उत्तर
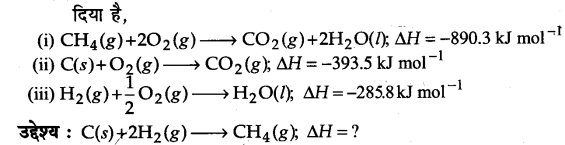

प्रश्न 6.
एक अभिक्रिया A+ B → C +D+q के लिए एन्ट्रॉपी परिवर्तन धनात्मक पाया गया। यह अभिक्रिया सम्भव होगी-
(i) उच्च ताप पर
(ii) निम्न ताप पर
(iii) किसी भी ताप पर नहीं
(iv) किसी भी ताप पर
उत्तर
यहाँ ∆H =-ve तथा ∆S = +ve. ∆G=∆H – T∆S; अभिक्रिया के स्वतः प्रवर्तित होने के लिए ∆G=-ve होनी चाहिए जोकि किसी भी ताप पर हो सकती है अर्थात् विकल्प (iv) सही है।
प्रश्न 7.
एक प्रक्रम में निकाय द्वारा 701 J ऊष्मा अवशोषित होती है एवं 394J कार्य किया जाता है। इस प्रक्रम में आन्तरिक ऊर्जा में कितना परिवर्तन होगा?
उत्तर

प्रश्न 8.
एक बम कैलोरीमीटर में NH2CN (s) की अभिक्रिया डाइऑक्सीजन के साथ की गई एवं ∆U का मान-742.7 kJ mol-1 पाया गया (298K पर)। इस अभिक्रिया के लिए 298K पर एन्थैल्पी परिवर्तन ज्ञात कीजिए:-
उत्तर

प्रश्न 9.
60.0 g ऐलुमिनियम का ताप 35°C से 55°C करने के लिए कितने kJ ऊष्मा की आवश्यकता होगी? Al की मोलर ऊष्माधारिता 24Jmol-1 K-1 है।
उत्तर

प्रश्न 10.
10.0°C पर 1 मोल जल की बर्फ – 10°C पर जमाने पर एन्थैल्पी-परिवर्तन की गणना कीजिए।
∆fus H = 6.03 kJ mol-10°C पर,
Cp[H2O(l)] = 75.3Jmol-1 K-1
Cp[H2O(s)] = 36.8 Jmol-1K-1
उत्तर
∆Htotal=(10°C पर 1 मोल जल → 0°C पर 1 मोल जल)

प्रश्न 11.
CO2 की दहन एन्थैल्पी – 393.5 kJ mol-1 है। कार्बन एवं ऑक्सीजन से 35.2 g CO2 बनने पर उत्सर्जित ऊष्मा की गणना कीजिए।
उत्तर

प्रश्न 12.
CO(g), CO2(g), N2O(g) एवं N2O4(g) की विरचन एन्थैल्पी क्रमशः-110,393, 81 एवं 9.7 kmol-1 हैं। अभिक्रिया N2O4 (g) +3C0(g) →N2O(g)+3CO2(g) के लिए ∆rH⊖ का मान ज्ञात कीजिए।
उत्तर

प्रश्न 13.
N2(g)+3H2(g) → 2NH3(g); ∆rH⊖ = -92-4kJ mol-1 NH3 गैस की मानक विरचन एन्थैल्पी क्या है?
उत्तर

प्रश्न 14.
निम्नलिखित आँकड़ों से CH3OH(l) की मानक विरचन एन्थैल्पी ज्ञात कीजिए-

उत्तर

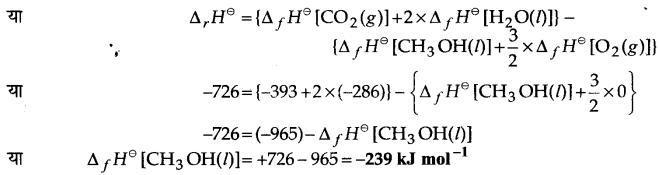
प्रश्न 15.
CCl3(g) → C(g) + 4CI(g) अभिक्रिया के लिए एन्थैल्पी-परिवर्तन ज्ञात कीजिए एवं CCl3 में C-Cl की आबन्ध एन्थैल्पी की गणना कीजिए-
∆vapH⊖ (CCl4) = 30.5 kJ mol-1
∆fH⊖ (CCl4) = -1355 kJ mol-1
∆aH⊖ (C) = 715.0 kJ mol-1,
∆aH⊖(Cl2) = 242 kJ mol-1
यहाँ ∆aH⊖ परमाण्वीकरण एन्थैल्पी है।
उत्तर

प्रश्न 16.
एक विलगित निकाय के लिए ∆U = 0, इसके लिए AS क्या होगा?
उत्तर
यहाँ ∆U का मान शून्य है जिसका तात्पर्य है कि यहाँ ऊर्जा कारक की कोई भूमिका नहीं है। ∆U = 0 दोनों पर प्रक्रम तभी स्वत: प्रवर्तित हो सकता है जब एंट्रॉपी कारक प्रक्रम कराने में सहायक हो अर्थात् AS का मान धनात्मक (+ ve) होगा।
प्रश्न 17.
298 K पर अभिक्रिया 2A+ B → c के लिए।
∆H = 400 kJ mol-1 एवं ∆S = 0.2 kJ K-1mol-1
∆H एवं ∆S को ताप-विस्तार में स्थिर मानते हुए बताइए कि किस ताप पर अभिक्रिया स्वतः होगी?
उत्तर

प्रश्न 18.
अभिक्रिया 2Cl(g) → Cl2(g) के लिए ∆H एवं ∆S के चिह्न क्या होंगे?
उत्तर
दी गयी अभिक्रिया में आबन्ध निर्माण होता है, अतः ऊर्जा निर्मुक्त होती है अर्थात् ∆H
ऋणात्मक होता है। पुनः 2 मोल परमाणुओं की यादृच्छिकता (randomness) 1 मोल अणुओं से अधिक होती है, अतः यादृच्छिकता घटती है अर्थात् ∆S ऋणात्मक होगा।
प्रश्न 19.
अभिक्रिया 2A(g) + B (g) → 2D (g) के लिए ∆U⊖ = -10.5 kJ एवं ∆S⊖ =-44.1JK-1 अभिक्रिया के लिए ∆G⊖ की गणना कीजिए और बताइए कि क्या अभिक्रिया स्वत:प्रवर्तित हो सकती है?
उत्तर

प्रश्न 20.
300 K पर एक अभिक्रिया के लिए साम्य स्थिरांक 10 है। ∆G⊖ का मान क्या होगा? (R = 8.314 JK-1mol-1)
उत्तर

प्रश्न 21.
निम्नलिखित अभिक्रियाओं के आधार पर NO(g) तथा NO2(g) के ऊष्मागतिकी स्थायित्व पर टिप्पणी कीजिए-
N2(g) + O2(g) → NO(g); ∆rH⊖ = 90 kJ mol-1
NO(g) + O2(g) → NO2(g); ∆rH⊖ =-74 kJ mol-1
उत्तर
NO(g) के निर्माण में ऊर्जा अवशोषित होती है, अत: NO(g) अस्थायी है। चूंकि दूसरी अभिक्रिया में ऊर्जा निर्मुक्त होती है, अत: NO2(g) स्थायी है। अत: अस्थायी NO(g) स्थायी NO2(g) में परिवर्तित होती है।
प्रश्न 22.
जब 1.00 mol H2O(l) को मानक परिस्थितियों में विरचित किया जाता है, तब परिवेश के एन्ट्रॉपी-परिवर्तन की गणना कीजिए। (∆fH⊖ = -286 kJ mol-1 )
उत्तर

परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
जब निकाय को ऊष्मा (q) दी जाए तथा निकाय के द्वारा » कार्य किया जाए तो ऊष्मागतिकी के प्रथम नियम का गणितीय रूप होता है-
(i) ∆E =q+w
(ii) ∆E =q-W
(iii) ∆E =-q+w
(iv) ∆E =-q-W
उत्तर
(ii) ∆E =q-w
प्रश्न 2.
किसी आदर्श गैस के समतापी प्रसार में
(i) आन्तरिक ऊर्जा घटती है।
(ii) आन्तरिक ऊर्जा बढ़ती है।
(iii) संपूर्ण ऊर्जा घटती है
(iv) आन्तरिक ऊर्जा स्थिर रहती है।
उत्तर
(iv) आन्तरिक ऊर्जा स्थिर रहती है।
प्रश्न 3.
एन्थैल्पी ∆H और आन्तरिक ऊर्जा ∆E में सम्बन्ध है|
(i) ∆E = ∆H + P∆V
(ii) ∆E+∆V = ∆H
(iii) ∆H = ∆U+ P∆V
(iv) ∆H = ∆E-P∆V
उत्तर
(iii) ∆H = ∆U+ P∆V
प्रश्न 4.
निकाय के एन्थैल्पी परिवर्तन ∆H और आन्तरिक ऊर्जा परिवर्तन ∆E में सम्बन्ध है-
(i) ∆E = ∆H + P∆U
(ii) ∆E = ∆H+∆nRT
(iii) ∆H = ∆U+∆nRT
(iv) ∆H = ∆E – P∆U
उत्तर
(iii) ∆H = ∆U+∆nRT
प्रश्न 5.
हाइड्रोजन गैस की 25°C पर दहन ऊष्मा -68.4 kcal है। जल की 25°C पर सम्भवन ऊष्मा होगी-
(i) – 34.2 kcal
(ii) -68.4kcal
(iii) – 136.8 kcal
(iv) + 68.4 kcal
उत्तर
(ii) – 68.4 kcal
प्रश्न 6.
समीकरण H2(g)+Cl2(g) 2HCl(g)+ 44.0 kcal से निष्कर्ष निकलता है कि HCI(g) की सम्भवन ऊष्मा है|
(i) – 44.0 kcal
(ii) + 22.0 kcal
(iii) – 22.0 kcal
(iv) +44.0 kcal
उत्तर
(iii)-22.0 kcal
प्रश्न 7.
1 मोल H2O2 का प्लेटिनमें ब्लैक द्वारा अपघटन होता है, 96.6 kJ ऊष्मा उत्पन्न होती है। 1 मोल H2O की सम्भवन ऊष्मा है-
(i) 193.2 kJ
(ii) 48.3 kJ
(iii) 96.6 kJ
(iv) 386.4kJ
उत्तर
(iii) 96.6 kJ
प्रश्न 8.
CO2 की सम्भवन ऊष्मा –90.4 किलोकैलोरी है। यह दर्शाता है कि-
(i) CO2 ऊष्माक्षेपी यौगिक है।
(ii) CO2 ऊष्माशोषी यौगिक है।
(iii) CO2 समतापीय यौगिक है।
(iv) इनमें से कोई नहीं
उत्तर
(i) CO2 ऊष्माक्षेपी यौगिक है
प्रश्न 9.
सही सम्बन्ध चुनिए|
(i) Qp =-∆H
(ii) Qv = ∆H
(iii) Qp = ∆E
(iv) Qv = ∆E
उत्तर
(ii) Qv = ∆H
प्रश्न 10.
अभिक्रिया H2(g) + Cl2(g) → 2HCl(g) के एन्थैल्पी परिवर्तन, ∆H का मान – 68.4 Kcal है। इसका ऋण चिह्न प्रदर्शित करता है-
(i) अभिकारकों की एन्थैल्पी से उत्पादों की एन्थैल्पी अधिक है।
(ii) अभिकारकों की एन्थैल्पी से उत्पादों की एन्थैल्पी कम है।
(iii) अभिक्रिया ऊष्माशोषी है।
(iv) अभिक्रिया अग्र दिशा में नहीं होती है।
उत्तर
(ii) अभिकारकों की एन्थैल्पी से उत्पादों की एन्थैल्पी कम है।
प्रश्न 11.
मेथेन, ऐसीटिलीन, एथिलीन तथा बेंजीन की दहन ऊष्माएँ क्रमशः – 213, -310, – 337 तथा – 410 kcal हैं। सबसे अच्छा ईंधन है|
(i) मेथेन
(ii) ऐसीटिलीन
(iii) एथिलीन
(iv) बेंजीन
उत्तर
(iv) बेंजीन
प्रश्न 12.
मानक अवस्थाओं की स्थितियाँ हैं-
(i) 25 K तथा 1 atm
(ii) 0°C तथा 1 atm
(iii) 20°C तथा 1 atm
(iv) 25°C तथा 1 atm
उत्तर
(iv) 25°C तथा 1 atm
प्रश्न 13.
अभिक्रिया की स्वतः प्रवर्तित होने की कसौटी है
(i) AG का ऋणात्मक होना
(ii) AG का धनात्मक होना
(iii) AG का मान शून्य होना
(iv) AG धनात्मक तथा AS ऋणात्मक होना
उत्तर
(i) AG का ऋणात्मक होना
प्रश्न 14.
जब बर्फ पिघलती है, तो इसकी एंटॉपी|
(i) घटती है
(ii) बढ़ती है
(iii) शून्य हो जाती है
(iv) स्थिर रहती है
उत्तर
(ii) बढ़ती है।
प्रश्न 15.
कपूर को वाष्पीकृत करने पर इसकी एंट्रॉपी-
(i) घटती है
(ii) बढ़ती है।
(iii) स्थिर रहती है।
(iv) शून्य हो जाती है।
उत्तर
(ii) बढ़ती है।
प्रश्न 16.
CH3COOH तथा NaOH की उदासीनीकरण ऊष्मा होती है-
(i) -13.6 Kcal/mol
(ii) -13.6 Kcal/mol से अधिक ऋणात्मक
(iii) -13.6 Kcal/mol से कम ऋणात्मक
(iv) उपर्युक्त में से कोई नहीं
उत्तर
(iv) उपर्युक्त में से कोई नहीं
प्रश्न 17.
36.5 ग्राम HCI और 40 ग्राम NaOH के द्वारा उत्पन्न होने वाली उदासीनीकरण ऊष्मा का मान होगा-
(i) 76.5 किलोकैलोरी
(ii) 12.7 किलोकैलोरी
(iii) शून्य
(iv) 13.7 किलोकैलोरी
उत्तर
(iv) 13.7 किलोकैलोरी
प्रश्न 18.
अभिक्रिया H2+Cl2 → 2HCl में ∆H = -194 kJ HCI की उत्पादन ऊष्मा है-
(i) + 19 kJ
(ii) + 194 kJ
(iii) – 194 kJ
(iv) – 97 kJ
उत्तर
(iv)-97 kJ
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
ऊष्मागतिकी से आप क्या समझते हैं?
उत्तर
विज्ञान की वह शाखा जिसके अन्तर्गत विभिन्न प्रकार की ऊर्जाओं के मध्य सम्बन्धों तथा उनके अन्तरापरिवर्तनों का अध्ययन किया जाता है, ऊष्मागतिकी कहलाती है।
प्रश्न 2.
आन्तरिक ऊर्जा से आप क्या समझते हैं?
उत्तर
निश्चित परिस्थितियों में किसी निकाय में ऊर्जा की एक निश्चित मात्रा उपस्थित होती है जो उसके पदार्थ की प्रकृति एवं मात्री तथा उसके ताप, दाब और आयतन पर निर्भर करती है। निश्चित परिस्थितियों में किसी निकाय में उपस्थित ऊर्जा की कुल मात्रा उसकी आन्तरिक ऊर्जा E कहलाती है। किसी पदार्थ या निकाय की आन्तरिक ऊर्जा का वास्तविक मान ज्ञात नहीं है, परन्तु किसी भौतिक या रासायनिक प्रक्रम में होने वाले ऊर्जा ,परिवर्तन को ज्ञात किया जा सकता है। माना किसी तन्त्र की प्रारम्भिक तथा अन्तिम अवस्थाओं में ऊर्जा क्रमशः E1 व E2 हों तथा ऊर्जा में परिवर्तन ∆E हो, तो
∆E = E2 – E1
यदि ∆E का मान धनात्मक है तो अभिक्रिया ऊष्माशोषी होगी और यदि ∆E का मान ऋणात्मक है तो अभिक्रिया ऊष्माक्षेपी होगी।
प्रश्न 3.
किसी निकाय को 40 जूल ऊष्मा देने पर निकाय द्वारा 8 जूल कार्य किया गया। निकाय की आन्तरिक ऊर्जा में वृद्धि ज्ञात कीजिए।
उत्तर
आन्तरिक ऊर्जा में वृद्धि = दी गयी ऊष्मा – किया गया कार्य = 40- 8= 32 जूल।
प्रश्न 4.
अभिक्रिया ऊष्मा को समझाइए। या अभिक्रिया की ऊष्मा अथवा अभिक्रिया की एन्थैल्पी पर टिप्पणी लिखिए।
उत्तर
अभिक्रिया ऊष्मा, कैलोरी में ऊष्मा की वह मात्रा है जो किसी रासायनिक समीकरण द्वारा प्रकट पदार्थों की ग्राम-अणु मात्राओं की पूर्ण अभिक्रिया होने पर शोषित या उत्पन्न होती है।
उदाहरणार्थ-
C+ O2 → CO2 + 94,300 कैलोरी
इस क्रिया की अभिक्रिया ऊष्मा 94300 कैलोरी है।
प्रश्न 5.
एन्थैल्पी किसे कहते हैं? आन्तरिक ऊर्जा से इसका सम्बन्ध लिखिए।
उत्तर
निश्चित दशाओं में निकांय की आन्तरिक ऊर्जा तथा PV ऊर्जा का योग एन्थैल्पी कहलाता है। निकाय की एन्थैल्पी को अन्तर्निहित ऊष्मा अथवा पूर्ण ऊष्मा भी कहते हैं। इसे H से प्रदर्शित करते हैं।
H =U+ PV
जहाँ, H = निकाय की एन्थैल्पी, U = निकाय की आन्तरिक ऊर्जा, P = दाब तथा V = आयतन
प्रश्न 6.
ऊष्माक्षेपी तथा ऊष्माशोषी अभिक्रियाओं को उदाहरण देकर समझाइए।
उत्तर
ऊष्माक्षेपी अभिक्रिया–जिन रासायनिक अभिक्रियाओं में ऊष्मा उत्सर्जित होती है, उन्हें ऊष्माक्षेपी अभिक्रियाएँ कहते हैं।
उदाहरणार्थ-
C(s) + O2(g) → CO2(g); ∆H =- 94.3kcal (25°C)
यह एक ऊष्माक्षेपी अभिक्रिया है जिसमें 25°C और 1 वायुमण्डल दाब पर 94.3 kcal ऊष्मा उत्सर्जित होती है।
ऊष्माशोषी अभिक्रिया-जिन रासायनिक अभिक्रियाओं में ऊष्मा अवशोषित होती है, उन्हें ऊष्माशोषी अभिक्रियाएँ कहते हैं।
उदाहरणार्थ-
N2(g)+O2(g)–> 2NO(g); ∆H = + 43.2kcal (25°C)
यह एक ऊष्माशोषी अभिक्रिया है जिसमें 25°C और 1 वायुमण्डल दाब पर 43.2 kcal ऊष्मा अवशोषित होती है।
प्रश्न 7.
प्रावस्था रूपान्तरण में एंट्रॉपी किस प्रकार प्रभावित होती है? एक उदाहरण देकर समझाइए।
उत्तर
किसी पदार्थ की एंट्रॉपी ठोस अवस्था में न्यूनतम तथा गैस अवस्था में अधिकतम होती है।
Sठोस <Sद्रव <Sगैस
पानी की तीनों अवस्थाओं में एंट्रॉपी का क्रम इस प्रकार है
Sबर्फ <Sजल <Sभाप
प्रश्न 8.
ऊर्ध्वपातन ऊष्मा अथवा उर्ध्वपातन एन्थैल्पी क्या है?
उत्तर
किसी ठोस पदार्थ के 1 मोल को उसके गलनांक से नीचे ताप पर सीधे वाष्प अवस्था में परिवर्तित होने पर होने वाले एन्थैल्पी परिवर्तन को पदार्थ की ऊर्ध्वपातन ऊष्मा अथवा ऊर्ध्वपातन एन्थैल्पी कहते हैं।
प्रश्न 9.
जलयोजन ऊष्मा अथवा जलयोजन एन्थैल्पी से आप क्या समझते हैं?
उत्तर
एक मोल अनार्दै लवण के उपयुक्त संख्या में जल के मोलों में संयोजित होकर जलयोजित लवण बनाने में होने वाला एन्थैल्पी परिवर्तन जलयोजन ऊष्मा अथवा जलयोजन एन्थैल्पी कहलाता है।
प्रश्न 10.
संक्रमण ऊष्मा अथवा संक्रमण एन्थैल्पी को परिभाषित कीजिए।
उत्तर
किसी तत्त्व के 1 मोल के एक अपररूप से दूसरे में परिवर्तित होने पर होने वाला एन्थैल्पी परिवर्तन संक्रमण ऊष्मा अथवा संक्रमण एन्थैल्पी कहलाता है।
प्रश्न 11.
किसी प्रबल क्षार तथा प्रबल अम्ल की उदासीनीकरण की ऊष्मा स्थिर क्यों होती है?
उत्तर
प्रबल क्षार तथा प्रबल अम्लों की उदासीनीकरण ऊष्मा लगभग 13.7 किलोकैलोरी होती है। उदासीनीकरण ऊष्मा का स्थिर मान होना उनके तनु विलयनों में पूर्ण आयनन के कारण है। यदि प्रबल अम्ल HA तथा प्रबल क्षार BOH के ग्राम तुल्यांकी मात्राओं के तेनु विलयनों को मिलाया जाए, तो आयनिक सिद्धान्त के अनुसार,

उपर्युक्त समीकरणों से स्पष्ट है कि उदासीनीकरण ऊष्मा किसी अम्ल से उत्पन्न H+ आयनों तथा क्षार से उत्पन्न OH– आयनों के संयोग से बने जल की उत्पन्न ऊष्मा है; अत: उदासीनीकरण ऊष्मा जल की हाइड्रोजन तथा हाइड्रॉक्सिल आयनों से उत्पादन ऊष्मा के बराबर होती है। इस प्रकार, जल की उत्पादन ऊष्मा का मान सदैव लंगभग 13.7 किलोकैलोरी होता है; अत: उदासीनीकरण ऊष्मा का मान प्रबल अम्ल तथा प्रबल क्षार के लिए स्थिर रहता है।
प्रश्न 12.
CH4(g), C(s) और H2(g) की 25°C पर दहन ऊष्माएँ क्रमशः -212.8 kcal, 940 kcal और – 68.4 kcal हैं। मेथेन गैस की संभवन ऊष्मा ∆fH की गणना
कीजिए।
उत्तर

प्रश्न 13.
निम्नलिखित आँकड़ों के आधार पर मेथेन की दहन ऊष्मा की गणना कीजिए-
C2 + 2H2 → CH4;∆H = x kJ …………(i)
C + O2→ CO2; ∆H = y kJ …….(ii)
H2 +O2 → H2O; ∆H= kJ ……(iii)
मेथेन की दहन ऊष्मा का समीकरण है
CH4+ 2O2 + CO2 + 2H2O
उत्तर
समीकरण (iii) को 2 से गुणा करके, समीकरण (ii) में जोड़कर फिर उसमें समीकरण (i) को उल्टा करके जोड़ने पर,

प्रश्न 14.
स्थिर दाब एवं 17°C पर एथिलीन की उत्पादन ऊष्मा – 2.71 किलोकैलोरी है। स्थिर आयतन पर इसकी उत्पादन ऊष्मा ज्ञात कीजिए। R = 0.002 Kcal तथा
2C(s) + 2H2(g) → C2H4(g)
उत्तर

प्रश्न 15.
CO (g), CO2 (g) और H2O(g) की संभवन ऊष्माएँ क्रमशः -25.7,-93.2 तथा –56.4 kcal हैं। निम्नलिखित अभिक्रिया की अभिक्रिया ऊष्मा की गणना कीजिए-
CO2 (g)+H2(g) → CO(g) + H2O (g)
उत्तर

प्रश्न 16.
हेस का स्थिर ऊष्मा संकलन का नियम क्या है? उदाहरण देकर समझाइए।
उत्तर
हेस का स्थिर ऊष्मा योग नियम-यदि एक ही रासायनिक परिवर्तन एक या अधिक विधियों से, एक या अधिक पदों में पूर्ण किया जाये, तो पूर्ण परिवर्तन में उत्पन्न या शोषित ऊष्मा समान होती है। चाहे परिवर्तन किसी भी विधि से पूर्ण किया गया हो।
उदाहरणार्थ-
C(s) + O2(g) → CO2(g) + 94 kcal
इस अभिक्रिया को दो पदों में करने पर-
C(s) + O2 (g) → CO(g)+ 264 kcal
CO(g) +O2(g) → CO2(g) + 67.6 kcal
इन दोनों समीकरणों को जोड़ने पर-
C(s) +O2(g) → CO2(g)+ 94 kcal
इस प्रकार प्रत्येक दशा में एक मोल कार्बन के दहन से 94kcal ऊष्मा उत्सर्जित होती है। यह तथ्य हेस के नियम की पुष्टि करता है।
प्रश्न 17.
हेस के नियम का उघ्रयोग’ अपररूपों की रूपान्तरण ऊष्माओं की गणना करने में किस प्रकार किया जाता है?
उत्तर
किसी तत्त्व के एक अपरखप से दूसरे अपररूप में स्थानान्तरण होने में उत्सर्जित या अवशोषित ऊष्मा की मात्रा का निर्धारण प्रयोग द्वारा नहीं किया जा सकता है क्योंकि सामान्यत: केवल ताप बदलने से एक अपररूप दूसरे अपररूप में परिवर्तित नहीं होता है। अपररूपों की दहन ऊष्माओं का मान प्रयोग द्वारा प्राप्त कर लेते हैं। माना कार्बन के दोनों अपररूपों Caiamond एवं Canhite की दहन ऊष्माएँ a तथा b हैं-
Cdiamond +O2 → CO2(g); ∆H = akcal …(i)
Cgraphite +O2 → CO2(g); ∆H = b kcal…(ii)
समी० (i) – समी० (i) करने पर
Cdiamond – Cgraphite ∆H =a-b kcal
प्रश्न 18.
निम्नलिखित पर संक्षिप्त टिप्पणी लिखिए
(i) उत्पादन यो सम्भवन ऊष्मा,
(ii) दहन ऊष्मा
उत्तर
(i) उत्पादन या सम्भवन ऊष्मा—किसी यौगिक के अपने तत्त्वों से एक ग्राम-अणु बनाने में जितनी ऊष्मा की मात्रा उत्पन्न या अवशोषित होती है, वह उस यौगिक की उत्पादन यो सम्भवन ऊष्मा कहलाती है;
जैसे-
C+O2 → CO2 + 94,300 cal
C+ 2S → CS2 -19,800 cal
CO2 तथा CS2 की उत्पादन ऊष्माएँ क्रमश: 94,300 कैलोरी और -19,800 कैलोरी हैं।
(ii) दहन ऊष्मा–किसी यौगिक या तत्त्व के एक ग्राम-अणु के पूर्ण दहन पर जो ऊष्मा उत्पन्न होती है, वह उसकी दहन ऊष्मा कहलाती है; जैसे
CH4 + 2O2 → CO2 + 2H2O+ 21,000 कैलोरी
C+O2 → CO2 +94,300 कैलोरी
अतः मेथेन तथा कार्बन की दहन ऊष्माएँ क्रमशः 21,000 तथा 94,300 कैलोरी हैं।
प्रश्न 19.
स्वतः प्रवर्तित व स्वतः अप्रवर्तित प्रक्रम से आप क्या समझते हैं?
उत्तर
स्वतः प्रवर्तित प्रक्रम–ऐसे प्रक्रम जो कुछ विशिष्ट परिस्थितियों में अपने आप या एक बार प्रारम्भ करने के पश्चात् अपने आप होते रहते हैं, स्वत: प्रवर्तित प्रक्रम कहलाते हैं।
स्वतः अप्रवर्तित प्रक्रम-ऐसे प्रक्रम जो न तो अपने आप और न ही एक बार प्रारम्भ करने के पश्चात् हो सकते हैं, स्वतः अप्रवर्तित प्रक्रम कहलाते हैं।
प्रश्न 20.
एंट्रॉपी पर संक्षिप्त टिप्पणी लिखिए।
उत्तर
किसी निकाय की एंट्रॉपी उस निकाय की अव्यवस्था या यादृच्छिकता की मात्रा की माप है। इसे S से प्रदर्शित करते हैं। निकाय की अव्यवस्था बढ़ने पर एंट्रॉपी बढ़ जाती है। एक निश्चित ताप पर निकाय की एंट्रॉपी परिवर्तित होती है। अवस्था परिवर्तन पर एंट्रॉपी परिवर्तित होती है। एंट्रॉपी परिवर्तन को ∆S से प्रदर्शित करते हैं।
∆S = S2 – S1 (जहाँ S2 तथा S1 अन्तिम तथा प्रारम्भिक अवस्था की एंट्रॉपी हैं।)
प्रश्न 21.
एंट्रॉपी पर ताप का क्या प्रभाव पड़ता है?
उत्तर
निकाय का ताप बढ़ने पर एंट्रॉपी बढ़ जाती है। एक निश्चित ताप पर एंट्रॉपी निश्चित होती है। तथा ताप परिवर्तन पर एंट्रॉपी परिवर्तित होती है।
प्रश्न 22.
रासायनिक परिवर्तनों में एंट्रॉपी परिवर्तन के चिह्न का अनुमान किस प्रकार लगाया जाता है? एक उदाहरण देकर स्पष्ट कीजिए।
उत्तर
वे प्रक्रम जिनमें AS एंट्रॉपी परिवर्तन का मान धनात्मक होता है अर्थात् जिनमें एंट्रॉपी बढ़ती है । वे स्वतः प्रवर्तित प्रक्रम हैं, जैसे- बर्फ का पिघलना, लवणों की ऊष्माशोषी इत्यादि।
लघु उत्तरीय प्रश्न
प्रश्न 1.
निकाय, परिवेश तथा परिसीमा को परिभाषित कीजिए। उदाहरण भी दीजिए।
उत्तर
निकाय–ब्रह्माण्ड का वह भाग जो ऊष्मागतिक अध्ययन के लिए चुना जाता है अर्थात् जिस पर प्रेक्षण होते हैं, निकाय कहलाता है।
परिवेश–निकाय को छोड़कर ब्रह्माण्ड का शेष भाग परिवेश कहलाता है।
परिसीमा–निकाय तथा परिवेश के मध्य एक वास्तविक या काल्पनिक परिसीमा होती है जो दोनों को एक-दूसरे से पृथक् करती है।
उदाहरणार्थ-जब हम बीकर में NaOH तथा HCl की अभिक्रिया का अध्ययन करते हैं तो अभिक्रिया मिश्रण निकाय, बीकर परिसीमा तथा बीकर के बाहर का सम्पूर्ण भाग निकाय को परिवेश होता है।
प्रश्न 2.
निकाय तथा परिवेश के मध्य द्रव्य एवं ऊर्जा के विनिमय के आधार पर निकाय को वर्गीकृत कीजिए।
उत्तर
निकाय तथा परिवेश के मध्य द्रव्य एवं ऊर्जा के विनिमय के आधार पर निकाय को निम्नलिखित तीन वर्गों में बाँटा जा सकता है–
- विवृत निकाय या खुला निकाय—जो निकाय अपने परिवेश के साथ द्रव्य तथा ऊर्जा दोनों का विनिमय कर सकता है, विवृत निकाय या खुला निकाय कहलाता है। उदाहरणार्थ-खुले बीकर में लिया गया जल। यह परिवेश से द्रव्य (वाष्प) तथा ऊर्जा (ऊष्मा) दोनों का ही विनिमय कर सकता है।
- संवृत भिकाय या बन्द निकाय—जो निकाय अपने परिवेश के साथ ऊर्जा का तो विनिमय कर सकता है परन्तु द्रव्य का नहीं कर सकता, संवृत निकाय या बन्द निकाय कहलाता है। उदाहरणार्थ-किसी बन्द धात्विक पात्र में लिया गया जल। पात्र की दीवारों के माध्यम से निकाय तथा परिवेश के मध्य ऊर्जा (ऊष्मा) का तो विनिमय हो सकता है परन्तु चूंकि पात्र बन्द है इसलिए निकाय तथा परिवेश के मध्य द्रव्य का विनिमय नहीं हो सकता।
- विमुक्त निकाय या विलगित निकाय—जो निकाय अपने परिवेश के साथ न तो ऊर्जा का विनिमय कर सकता है और न ही द्रव्य का, विमुक्त निकाय या विलगित निकाय कहलाता है। उदाहरणार्थ–एक ऊष्मारोधी तथा बन्द पात्र में लिया गया जल। यह अपने परिवेश में न तो ऊर्जा का विनिमय कर सकता है और न ही द्रव्य का।
प्रश्न 3.
संघटन के आधार पर निकाय कितने प्रकार के होते हैं? प्रत्येक का संक्षिप्त वर्णन कीजिए।
उत्तर
संघटन के आधार पर निकाय निम्नलिखित दो प्रकार के होते हैं
- समांगी निकाय—वह निकाय जिसकी प्रकृति सर्वत्र समान होती है, समांगी निकाय कहलाता है। यह केवल एक प्रावस्था का बना होता है। उदाहरणार्थ-शुद्ध ठोस; जैसे–सोडियम क्लोराइड, शुद्ध गैस; जैसे–ऑक्सीजन, वास्तविक विलयन; जैसे–चीनी का जल में विलयन आदि।
- विषमांगी निकाय—वह निकाय जिसकी प्रकृति सर्वत्र समान नहीं होती है, विषमांगी निकाय कहलाता है। इसमें एक से अधिक प्रावस्थाएँ होती हैं। उदाहरणार्थ-जल तथा वाष्प, बर्फ तथा जल, जल तथा तेल आदि।
प्रश्न 4.
विस्तीर्ण गुण तथा गहन गुण से आप क्या समझते हैं?
उत्तर
विस्तीर्ण गुण तथा गहन; गुण का वर्णन निम्नवत् है-
- विस्तीर्ण गुणवे गुण जो निकाय में उपस्थित पदार्थ (पदार्थों) की मात्रा पर निर्भर करते हैं। , विस्तीर्ण गुण कहलाते हैं। उदाहरणार्थ-द्रव्यमान, आयतन, ऊष्मा धारिता, आन्तरिक ऊर्जा, एन्ट्रॉपी, गिब्ज़ मुक्त ऊर्जा, पृष्ठ क्षेत्रफल आदि। ये गुण निकाय में उपस्थित पदार्थ की मात्रा के साथ बदलते रहते हैं। यदि हम अपनी सुविधानुसार निकाय को विभिन्न भागों में बाँट दें तो पदार्थ के विस्तीर्ण गुण का कुल मान उन भागों के विस्तीर्ण गुण के योग के बराबर होता है।
- गहन गुण-वे गुण जो निकाय में उपस्थित पदार्थ (पदार्थों) की मात्रा पर निर्भर नहीं करते हैं। गहन गुण कहलाते हैं। ये केवल पदार्थ (पदार्थों) की प्रकृति पर निर्भर करते हैं। ताप, दाब, घनत्व, श्यानता, पृष्ठ तनाव, गलनांक, क्वथनांक आदि ऐसे गुणों के उदाहरण हैं। दो विस्तीर्ण गुणों का अनुपात गहन होता हैं। इसलिए जब हम किसी पदार्थ की इकाई मात्रा के लिए किसी विस्तीर्ण गुण की बात करते हैं तो वह गहन गुण बन जाता है।
उदाहरणार्थ-द्रव्यमान द्रव्यं की मात्रा पर निर्भर करता है अर्थात् यह एक विस्तीर्ण गुण है। परन्तु द्रव्यमान प्रति इकाई आयतन अर्थात् घनत्व एक गहन गुण है जो पदार्थ की मात्रा पर निर्भर नहीं करता है।
प्रश्न 5.
ऊष्मागतिक साम्य का संक्षिप्त वर्णन कीजिए। या ऊष्मागतिकी का शून्य नियम क्या है?
उत्तर
जब किसी निकाय के स्थूल गुणों; जैसे–ताप, दाब आदि में समय के साथ कोई परिवर्तन नहीं होता है तो निकाय ऊष्मागतिक साम्य में कहलाता है। वास्तव में यह साम्य तभी प्राप्त होता है जब तीन साम्य एक साथ प्राप्त होते हैं। ये तीन साम्य निम्नवत् हैं-
- यांत्रिक साम्य-जब निकाय के अन्दर कोई स्थूल गति न हो या निकाय की परिवेश के सापेक्ष – कोई गति न हो तो निकाय यांत्रिक साम्य की स्थिति में कहलाता है। इसके लिए निकाय के यांत्रिक गुण एक समान तथा स्थिर होने चाहिए।
- रासायनिक साम्य-एक से अधिक पदार्थों वाला ऐसा निकाय जिसका संघटन समय के साथ परिवर्तित नहीं होता है, रासायनिक साम्य की अवस्था में कहलाता है।
- तापीय साम्य-जब किसी निकाय का ताप एक समान होता है तथा वह परिवेश के ताप के भी। समान होता है तो निकाय तापीय साम्य की अवस्था में कहलाता है। माना हमारे पास तीन निकाय A, B तथा C इस प्रकार हैं—A तथा B और B तथा C तापीय साम्य में हैं तब निकाय A तथा C भी तापीय साम्य में होंगे। यही ऊष्मागतिकी का शून्य नियम कहलाता है। इस नियम के अनुसार, “दो निकाय जो किसी तीसरे निकाय से तापीय साम्य में होते हैं उनमें आपस में भी तापीय साम्य होता है।”
प्रश्न 6.
ऊष्मा क्या है? इसके मात्रक तथा इसके लिए चिह्न परिपाटी के नियम लिखिए।
उत्तर
ऊष्मा–निकाय तथा परिवेश के मध्य ऊष्मा के रूप में ऊर्जा तब स्थानान्तरित होती है जब निकाय तथा परिवेश में तापान्तर होता है। यदि निकाय का ताप अधिक होता है तो निकाय परिवेश को ऊष्मा के रूप में ऊर्जा स्थानान्तरित करता है जिससे निकाय का ताप कम हो जाता है तथा परिवेश का ताप बढ़ जाता है। यह ऊर्जा ्थानान्तरण तब तक होता है जब तक कि निकाय और परिवेश का ताप समान नहीं हो जाता। यदि निकाय को ताप परिवेश के ताप से कम होता है तो ऊष्मा के रूप में ऊर्जा परिवेश से निकाय में स्थानान्तरित होती है जिससे निकाय का ताप बढ़ जाता है तथा परिवेश का ताप कम हो जाती है। ऊर्जा का यह स्थानान्तरण तब तक होता है जब तक परिवेश तथा निकाय का ताप समान नहीं हो जाता। ऊष्मा को q द्वारा निरूपित करते हैं।
मात्रक-ऊष्मा को सामान्यतः कैलोरी में मापा जाता है। S.I. पद्धति में ऊष्मा का मात्रक जूल होता है।
चिह्न परिपाटी–निकाय द्वारा अवशोषित ऊष्मा धनात्मक होती है जबकि निकाय द्वारा निष्कासित ऊष्मा ऋणात्मक होती है।
प्रश्न 7.
ऊष्मागतिकी के प्रथम नियम का गणितीय निगमन कीजिए। या ऊष्मागतिकी का प्रथम नियम क्या है? इसके गणितीय रूप का व्यंजक लिखिए। एन्थैल्पी तथा ऊर्जा परिवर्तन में क्या सम्बन्ध है?
उत्तर
ऊष्मागतिकी के प्रथम नियम के व्यंजक को प्राप्त करने के लिए एक ऐसे निकाय पर विचार करते हैं जिसकी आन्तरिक ऊर्जा U, है। इस निकाय की आन्तरिक ऊर्जा में वृद्धि दो विधियों द्वारा की जा सकती है—
- निकाय को ऊष्मा देकर तथा
- निकाय पर कार्य करके। यदि निकाय ‘g’ ऊष्मा अवशोषित करता है तो,

प्रश्न 8.
एन्थैल्पी परिवर्तन तथा एन्थैल्पी परिवर्तन की चिह्न परिपाटी को समझाइए।
उत्तर
एन्थैल्पी परिवर्तन-स्थिर दाब पर किसी निकाय द्वारा अवशोषित अथवा उत्सर्जित ऊष्मा निकाय का एन्थैल्पी परिवर्तन कहलाता है। इसे ∆H से प्रदर्शित करते हैं।
एन्थैल्पी परिवर्तन की चिह्न परिपाटी-ऊष्माक्षेपी प्रक्रमों के लिए एन्थैल्पी परिवर्तन ऋणात्मक जबकि ऊष्माशोषी प्रक्रमों के लिए एन्थैल्पी परिवर्तन धनात्मक होता है।
प्रश्न 9.
अभिक्रिया की एन्थैल्पी को प्रभावित करने वाले कारकों का वर्णन कीजिए।
उत्तर
अभिक्रिया की एन्थैल्पी निम्न कारकों द्वारा प्रभावित होती है-
- अभिकारकों की मात्रा–अभिक्रिया की एन्थैल्पी अभिकारकों की मात्रा पर निर्भर करती है। यदि अभिकारकों की मात्रा दोगुनी कर दी जाए तो अभिक्रिया की एन्थैल्पी भी दोगुनी हो जाती है। इसी प्रकार यदि अभिकारकों की मात्रा दस गुनी कर दी जाए तो अभिक्रिया की एन्थैल्पी भी दस गुनी हो जाती है।
- अभिकारकों तथा उत्पादों की भौतिक अवस्थाएँ–अभिकारकों तथा उत्पादों की भौतिक | अवस्था में परिवर्तन के साथ ही अभिक्रिया की एन्थैल्पी का मान भी बदल जाता है।
- ताप–अभिक्रिया की एन्थैल्पी का मान अभिकारकों और उत्पादों के ताप पर भी निर्भर करता है।
- अपररूप-विभिन्न अपररूपों (allotropes) के लिए भी A,H के मान भिन्न-भिन्न होते हैं।
उदाहरणार्थ-
S(रॉम्बिक) +O2 (g) → SO2(g); ∆rH = -297.0 kJ mol-1 S (मोनोक्लीनिक) +0, (g) -> SO, (g); A H =-297.3 kJmol
C (ग्रेफाइट) +O2 (g) →CO2 (g); ∆rH =-393.5kJmol-1
C (डायमंड) +O2 (g) → CO2 (g); ∆rH = -395.4kJmol-1 - विलयनों की सन्द्रिती-यदि अभिक्रिया में विलयन भी भाग लेते हैं तो उनकी सान्द्रता भी अभिक्रिया की एन्थैल्पी को प्रभावित करती है।।
- स्थिर दाब अथवा स्थिर आयतम की दशाएँ–अभिक्रिया की एन्थैल्पी इससे भी प्रभावित होती है कि अभिक्रिया स्थिर दाब पर होती है अथवा स्थिर आयतन पर।
प्रश्न 10.
निम्न को परिभाषित कीजिए-
1. आयनन ऊष्मा अथवा आयनन एन्थैल्पी
2. विलयन ऊष्मा अथवा विलयन एन्थैल्पी
3. आबन्ध ऊर्जा (एन्थैल्पी)
4. कणीकरण एन्थैल्पी
5. आबन्ध वियोजन एन्थैल्पी
उत्तर
- आयनन ऊष्मा अथवा आर्यनेने एन्थैल्पी—किसी पदार्थ के 1 मील के पूर्ण आयनेन में होने वाला एन्थैल्पी परिवर्तन आयनेन ऊष्मा अथवा आयनन एन्थैल्पी कहलाता है।
- विलयन ऊष्मा अथवा विलयन एन्यल्पीकिंसी पदार्थ की विलयन एन्थैल्पी वह एन्थैल्पी परिवर्तन है जो इसके 1 मोल को विलायक की निर्दिष्ट मात्रा में घोलने पर होता है। यदि विलायक की मात्रा इतनी अधिक हो किं और अधिक विलायक मिलाने पर कोई ऊष्मा परिवर्तन न हो तब इसे अनन्त तर्नुता पर विलयन एन्थैल्पी कहा जाता है।
- ओबन्ध एन्थैल्पी–र्किसी पदार्थ केक ग्रीम अणु की गैसीय अवस्था में विद्यमान सभी बन्धों को तोड़ने के लिए आवश्यक ऊर्जा उसकी आबन्ध एन्थैल्पी कहलाती है।
- कंणीकरण एन्थैल्पी–गैसीय अवस्था में किसी पदार्थ के 1 मोल में उपेंस्थित आबन्धों को | पूर्णतया तोड़कर परमाणुओं में बदलने में होने वाला एन्थैल्पी परिवर्तन कैणीकरण एन्थैल्पी कहलाता है। इसे ∆H से प्रदर्शित करते हैं।
- आबन्ध वियोजन एन्पी द्विपरमाणुक अणुओं के एक मोल में उपस्थित सभी आबन्धों को तोड़ने में हुआ एन्थैल्पी परिवर्तन आबन्ध वियोजन एन्थैल्पी कहलाती है। इसे:AH से व्यक्त करते हैं। उदाहरणार्थ—N2(g) → 2N(g); ∆H = + 945.6 किलोजूल/मौल अर्थात् N2(g) के एक मौले में उँपस्थितबन्धों को तोड़ने के लिए 945.6 किलोजूल ऊर्जा की आवश्यकता होती है।
प्रश्न 11.
हेस के नियम के अनुप्रयोग लिखिए।
उत्तर
हेस के नियम से पता चलता है कि ऊष्मरासायनिक समीकरणों को बीजीय समीकरणों के समान ही घटाया, जोड़ा, गुणा अथवा भाग किया जा सकता है। अत: हेस के नियम की सहायता से उन अभिक्रियाओं की ऊष्मा की गणना की जा सकती है जिनकी ऊष्मा सीधे प्रयोगों द्वारा निर्धारित नहीं की जा सकती। हेस के नियम के कुछ मुख्य अनुप्रयोग निम्नवत् हैं-
- विरचन एन्थैल्पी (अथवा सम्भवन एन्थैल्पी) की गणना–जिन यौगिकों को उनके तत्त्वों से सीधे नहीं बनाया जा सकता उनकी विरचन एंथैल्पियाँ कैलोरीमितीय विधियों (calorimetric methods) द्वारा ज्ञात नहीं की जा सकतीं। ऐसे यौगिकों की विरचन एन्थैल्पियाँ हेस के नियम | द्वारा ज्ञात की जा सकती हैं।
- संक्रमण एन्थैल्पी की गणना–संक्रमण (किसी पदार्थ के अपररूप का दूसरे में परिवर्तन) बहुत ही धीमी प्रक्रिया है; अतः विभिन्न पदार्थों के एक अपररूप से दूसरे में परिवर्तन (जैसे-डायमंड का ग्रेफाइट, पीले फॉस्फोरस का लाल फॉस्फोरस, रॉम्बिक सल्फर का मोनोक्लीनिक सल्फर में) के साथ होने वाले एन्थैल्पी परिवर्तन को सीधे नहीं मापा जा सकता। हेस के नियम की सहायता से विभिन्न पदार्थों की संक्रमण एन्थैल्पी की गणना की जा सकती
- जलंयोजन एन्थैल्पी की गणना-जलयोजन एन्थैल्पी को प्रयोगों द्वारा सीधे ज्ञात नहीं किया जा सकता परन्तु हेस के नियम द्वारा इसे आसानी से ज्ञात किया जा सकता है।
- हाइड्रोजनीकरण एन्थैल्पी की गणना--हेस के नियम की सहायता से हाइड्रोजनीकरण एन्थैल्पी भी ज्ञात की जा सकती है।
- अभिक्रियाओं की मानक एन्थैल्पी की मणना-यौगिकों की दहन एन्थैल्पियों और विरचन एन्थैल्पियों की जानकारी से हेस के नियम द्वारा अभिक्रियाओं की मानक एन्थैल्पियों की गणना की जा सकती है। विरचन एल्थैल्पियों की सहायता से ऊष्मरासायनिक गणनाएँ करने में यह ध्यान रखना चाहिए कि किसी अभिक्रिया की एन्थैल्पी ∆rH⊖ अभिक्रिया के उत्पादों की कुल एन्थैल्पी [Σ∆fH⊖ (Products)] तथा अभिकारकों की कुल एन्थैल्पी [Σ∆fH⊖ (Reactants)] का अन्तर होती है।
अर्थात् ∆rH⊖ = Σ∆fH⊖ (Products) – Σ∆fH⊖ (Reactants) - आबन्ध ऊर्जा की गणना-गैसीय अणुओं के क्रमाणुओं के मध्य उपस्थित एक मोल रासायनिक आबन्धों को तोड़ने के लिए आवश्यक ऊर्जा को आबन्धं ऊर्जा (bond energy) कहते हैं। इसे AH द्वारा प्रदर्शित करते हैं। यौगिकों की विरचन ऊष्माओं की जानकारी से उनकी आबन्ध ऊर्जाओं की गणना की जा सकती है तथा आबन्ध ऊर्जाओं की जानकारी से यौर्मिकों की विरचन ऊष्माओं की गणना की जा सकती है।
- अनुनाद ऊर्जा की गणना–हेस के नियम का प्रयोग ऊष्मरासायनिक आँकड़ों की सहायता से अनुनाद ऊर्जा की गणना करने में भी किया जाता है। किसी संरचना के लिए अभिक्रिया ” एन्थैल्पी परिकलित (सैद्धान्तिक रूप से) तथा प्रेक्षित (प्रयोगों द्वारा) मानों के अन्तर को अनुनाद ऊर्जा कहते हैं।
प्रश्न 12.
निम्न को परिभाषित कीजिए
1. गलन एंट्रॉपी,
2. वाष्पन एंट्रॉपी तथा
3. ऊर्ध्वपातन ऐट्रॉपी
उत्तर
1. गलन एंट्रॉपी-किसी ठोस पदार्थ के 1 मोल के उसके गलनांक पर द्रव में परिवर्तित होने पर होने वाला एंट्रॉपी परिवर्तन गलन एंट्रॉपी कहलाती है। इसका मान सदैवन्धनात्मक होता है क्योंकि सुव्यवस्थित क्रिस्टलीय ठोस में द्रव की अव्यवस्थित संरचना में संक्रमी में अव्यवस्था में वृद्धि होती है। इसे ∆fusS द्वारा प्रदर्शित करते हैं।

2. वाष्पन एंट्रॉपी-किसी द्रव पदार्थ के 1 मोल के उसके क्वथनांक पर वाष्प में परिवर्तित होने पर होने वाला एंट्रॉपी परिवर्तन वाष्पन एंट्रॉपी कहलाता है। इसे ∆vapS द्वारा प्रदर्शित करते हैं। वाष्पन एंट्रॉपी का मान सदैव धनात्मक होता है क्योंकि कम अव्यवस्थित द्रव से अत्यधिक अव्यवस्थित गैस में परिवर्तन पर अव्यवस्था में वृद्धि होती है। गणितीय रूप में,

3. ऊर्ध्वपातन एंट्रॉपी-किसी ठोस पदार्थ के 1 मोल के उसके सीधे वाष्प में परिवर्तित होने पर होने वाला एंट्रॉपी परिवर्तन ऊर्ध्वपातन एंट्रॉपी कहलाता है। इसे ∆subS द्वारा प्रदर्शित करते हैं। गणितीय रूप में,

प्रश्न 13.
ऊष्मागतिकी का द्वितीय नियम क्या है? स्थिर आयतन तथा 27°C पर CO की दहन ऊष्मा -66.7 किलोकैलोरी है। स्थिर दाब पर इसकी दहन ऊष्मा ज्ञात कीजिए।
उत्तर
इस नियम के अनुसार, स्वत: प्रवर्तित प्रक्रम ऊष्मागतिकीय रूप से अनुत्क्रमणीय होते हैं।” या “बाह्य साधनों का प्रयोग किये बिना स्वत: प्रवर्तित प्रक्रमों को उत्क्रमित नहीं किया जा सकता है।” या “किसी स्वत: प्रवर्तित प्रक्रम के लिए कुल एंट्रॉपी परिवर्तन धनात्मक होता है।” या “ब्रह्माण्ड की एंट्रॉपी में निरन्तर वृद्धि हो रही है।”
CO की दहन ऊष्मा का समीकरण

प्रश्न 14.
ऊष्मागतिकी का तृतीय नियम लिखिए। इसका एक अनुप्रयोग भी बताइए।
या
ऊष्मागतिकी के तृतीय नियम का उल्लेख कीजिए।
उत्तर
इस नियम के अनुसार, “परम शून्य ताप पर किसी पूर्ण क्रिस्टलीय पदार्थ की एंट्रॉपी शून्य मानी जा सकती है।”
यह नियम वाल्थर नर्स्ट ने सन् 1906 में दिया था। परम शून्य ताप पर शुद्ध क्रिस्टल के कणों में कोई गति नहीं होती है और वे पूर्ण रूप से व्यवस्थित होते हैं।
ऊष्मागतिकी के तृतीय नियम का प्रयोग शुद्ध पदार्थों की विभिन्न तापों पर निरपेक्ष एंट्रॉपियों की गणना करने में किया जाता है।
विस्तृत उत्तरीय प्रश्न
प्रश्न 1.
∆U तथा ∆H का मापन (कैलोरीमिति) किस प्रकार किया जाता है? विस्तृत वर्णन कीजिए।
उत्तर
∆U तथा ∆H का मापन-कैलोरीमिति रासायनिक एवं भौतिक प्रक्रमों से सम्बन्धित ऊर्जा परिवर्तन को जिस प्रायोगिक तकनीक द्वारा ज्ञात करते हैं उसे कैलोरीमिति (calorimetry) कहते हैं। कैलोरीमिति में प्रक्रम एक पात्र में किया जाता है। जिसे कैलोरीमीटर (calorimeter) कहते हैं। कैलोरीमीटर की सहायता से ऊष्मा परिवर्तन का मापन दो स्थितियों में—
- स्थिर आयतन पर (q,, अथवा AU) तथा
- स्थिर दाब पर (q, अथवा AH) किया जा सकता है।
∆U का मापन–रासायनिक अभिक्रियाओं के लिए स्थिर आयतन पर ऊर्जा परिवर्तन का मापन बम कैलोरीमीटर में किया जाता है जिसमें एक स्टील का पात्र होता है जिसे बम (bomb) कहते हैं। बम भारी स्टील का बना होता है तथा काफी मजबूत होता है क्योंकि इसे काफी उच्च दाब सहन करना होता है। बम एक वायुरुद्ध ढक्कन द्वारा ढका रहता है। बम में एक प्लेटिनम का कप होता है जिसमें पदार्थ लिया जाता है। बम में दो इलेक्ट्रोड भी होते हैं जो कप में फिलामेंट (filament) से जुड़े होते हैं। बम में ऑक्सीजन के प्रवेश की भी व्यवस्था होती है। बम को एक बड़े पात्र में रखा जाता है जिसमें जल भरा रहता है। साथ ही इस पात्र में एक थर्मामीटर तथा विलोडक भी रहते हैं। इस पूरी व्यवस्था को एक ऊष्मारोधी जैकेट में बन्द किया जाता है।

विधि-प्रतिदर्श की निश्चित (तोली गयी) मात्रा को प्लेटिनम कप में लिया जाता है। बम में उच्च दाब पर ऑक्सीजन को भी प्रवेश कराया जाता है। फिर फिलामेंट में विद्युत धारा प्रवाहित करके प्रतिदर्श को जलाया जाता है। अभिक्रिया में उत्पन्न ऊष्मा जले को स्थानान्तरित हो जाती है। उसके पश्चात् थर्मामीटर की सहायता से ताप ज्ञात कर लेते हैं। चूँकि अभिक्रिया एक बन्द पात्र में होती है अतः आयतन में कोई परिवर्तन नहीं होता है और कोई कार्य भी नहीं किया जाता है। यहाँ तक कि गैसों से सम्बन्धित रासायनिक अभिक्रियाओं में कोई भी कार्य नहीं होता है क्योंकि ∆V = 0 कैलोरीमीटर की ऊष्माधारिता ज्ञात होने पर निम्न सूत्रे की सहायता से ताप परिवर्तन (∆T) को ∆U(qv) में परिवर्तित कर लिया जाता है-
∆U=qv =C∆T
जहाँ, C = कैलोरीमीटर की ऊष्माधारिता, ∆T = जल के ताप में परिवर्तन
प्रतिदर्श की मात्रा ज्ञात होने पर निम्न सूत्र की सहायता से प्रति मोल आन्तरिक ऊर्जा परिवर्तन ज्ञात कर लिया जाता है-
जहाँ, C = कैलोरीमीटर की ऊष्माधारिता, AT = ताप परिवर्तन
M = प्रतिदर्श का मोलर द्रव्यमान, m= लिए गए प्रतिदर्श का द्रव्यमान
∆H का मापन–स्थिर दाब (सामान्यतः वायुमण्डलीय दाब) पर ऊष्मा परिवर्तन (q, अथवा AH) कॉफी कप कैलोरीमीटर (coffee cup calorimeter) की सहायता से ज्ञात किया जा सकता है। कॉफी कप कैलोरीमीटर में एक पॉलीस्टाइरीन का कप (ढक्कन सहित) होता है। जब किन्हीं दो विलयनों के मध्य होने वाली अभिक्रिया (माना की अभिक्रिया ऊष्माक्षेपी है) में एन्थैल्पी परिवर्तन ज्ञात करना होता है तो उनमें से एक विलयन की निश्चित मात्रा को कॉफी-कप कैलोरीमीटर में लेकर उसका थर्मामीटर की सहायता से तापे ज्ञात कर लेते हैं। इसके पश्चात् दूसरे विलयन (ज्ञात मात्रा) का भी ताप ज्ञात कर लेते हैं। फिर दूसरे विलयन की निश्चित मात्रा को कैलोरीमीटर में डालकर अभिक्रिया मिश्रण को विलोडक की सहायता से चलाकर मिश्रण के ताप में हुई वृद्धि ज्ञात कर लेते हैं। मिश्रण के ताप में हुई वृद्धि की सहायता से अभिक्रिया में उत्पन्न ऊष्मा निम्न प्रकार ज्ञात कर सकते हैं-

माना विलयनों का ताप = t1°C,
मिश्रण का अधिकतम ताप = t2°C
दोनों विलयनों का कुल द्रव्यमान = m
विलयन की विशिष्ट ऊष्मा = s,
तब अभिक्रिया में उत्पन्न ऊष्मा, q= mxsx(t2-t1) = mxsx∆t विलयनों के ताप भिन्न होने की दशा में उन्हें वाटर बाथ (water bath) में रखकर उनके ताप समान कर लिए जाते हैं। स्थिर दाब पर उत्सर्जित अथवा अवशोषित ऊष्मा qp अभिक्रिया की ऊष्मा अथवा अभिक्रिया की एन्थैल्पी ∆rH कहलाती है। ऊष्मारोधी अभिक्रियाओं में ऊष्मा निर्मुक्त होती है तथा निकाय से परिवेश में ऊष्मा का प्रवाह होता है। इसलिए qp ऋणात्मक होता है तथा ∆r भी ऋणात्मक होता है। इसी तरह ऊष्माक्षेपी अभिक्रियाओं में ऊष्मा अवशोषित होती है अतः qp और ∆r दोनों धनात्मक होते हैं। कॉफी कप कैलोरीमीटर के स्थान पर ∆H के मापन के लिए हम एक अन्य कैलोरीमीटर का प्रयोग भी कर सकते हैं जिसमें अभिक्रिया एक ऐसे पात्र में करायी जाती है जिसकी दीवारें ऊष्मा की सुचालक होती हैं। यह पात्र एक अन्य बड़े ऊष्मारोधी दीवारों वाले पात्र में स्थित रहता है जिसमें जल होता है। जल में थर्मामीटर तथा विलोडक भी रहते हैं। अभिक्रिया में उत्पन्न/अवशोषित ऊष्मा के कारण जल के ताप में परिवर्तन होता है। इसी ताप परिवर्तन को उपर्युक्त सूत्रे द्वारा qp अथवा ∆H में परिवर्तित कर लिया जाता है।
We hope the UP Board Solutions for Class 11 Chemistry Chapter 6 Thermodynamics (ऊष्मागतिकी) help you. If you have any query regarding UP Board Solutions for Class 11 Chemistry Chapter 6 Thermodynamics (ऊष्मागतिकी), drop a comment below and we will get back to you at the earliest.