UP Board Solutions for Class 12 Chemistry Chapter 1 The Solid State (ठोस अवस्था)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
ठोस कठोर क्यों होते हैं?
उत्तर
ठोस कठोर होते हैं, क्योंकि इनके अवयवी कण अत्यन्त निविड संकुलित होते हैं। इनमें कोई स्थानान्तरीय गति नहीं होती है तथा ये केवल अपनी माध्य स्थिति के चारों ओर कम्पन कर सकते हैं।
प्रश्न 2.
ठोसों का आयतन निश्चित क्यों होता है?
उत्तर
ठोस के अवयवी कणों की स्थिति नियत होती है तथा वे गति के लिए स्वतन्त्र नहीं होते हैं। इसलिए इनका आयतन निश्चित होता है।
प्रश्न 3.
निम्नलिखित को अक्रिस्टलीय तथा क्रिस्टलीय ठोसों में वर्गीकृत कीजिए पॉलियूरिथेन, नैफ्थेलीन, बेन्जोइक अम्ल, टेफ्लॉन, पोटैशियम नाइट्रेट, सेलोफेन, पॉलिवाइर्निल क्लोराइड, रेशा काँच, ताँबा।
उत्तर
अक्रिस्टलीय ठोस – पॉलियूरिथेन, फ्लॉन, सेलोफेन, पॉलिवाइनिल, क्लोराइड, रेशा काँच।
क्रिस्टलीय ठोस – नैफ्थेलीन, बेन्जोइक अम्ल, पोटैशियम नाइट्रेट, ताँबा।
प्रश्न 4.
काँच को अतिशीतित द्रव क्यों माना जाता है?
उत्तर
क्योंकि यह ठोस होते हुए भी द्रवों के कुछ गुण प्रदर्शित करता है। द्रवों के समान इसमें प्रवाहित होने का गुण होता है। इसका यह गुण पुरानी इमारतों के काँच में देखा जा सकता है जो तली पर कुछ मोटा होता है। यह केवल तभी सम्भव है जबकि यह अत्यन्त मन्द गति से द्रवों के समान प्रवाहित हो।
प्रश्न 5.
एक ठोस के अपवर्तनांक का मान सभी दिशाओं में समान प्रेक्षित होता है। इस ठोस की प्रकृति पर टिप्पणी कीजिए। क्या यह विदलन गुण प्रदर्शित करेगा?
उत्तर
चूँकि ठोस के अपवर्तनांक का मान सभी दिशाओं में समान है। अत: यह समदेशिक प्रकृति का है। अतः यह अक्रिस्टलीय ठोस है। यह स्वच्छ विदलने गुण प्रदर्शित नहीं करेगा।
प्रश्न 6.
उपस्थित अन्तराआण्विक बलों की प्रकृति के आधार पर निम्नलिखित ठोसों को विभिन्न संवर्गों में वर्गीकृत कीजिए-पोटैशियम सल्फेट, टिन, बेंजीन, यूरिया, अमोनिया, जल, जिंक सल्फाइड, ग्रेफाइट, रूबिडियम, आर्गन, सिलिकन कार्बाइड।
उत्तर
पोटैशियम सल्फेट = आयनिक, टिन = धात्विक, बेंजीन = आण्विक (अध्रुवीय), यूरिया = आण्विक (ध्रुवीय), अमोनिया = आण्विक (हाइड्रोजन आबन्धित), जल = आण्विक (हाइड्रोजन आबन्धित), जिंक सल्फाइड = आयनिक, ग्रेफाइट = सहसंयोजी, रूबिडियम = धात्विक, आर्गन = आण्विक (अध्रुवीय), सिलिकन कार्बाइड = सहसंयोजी या नेटवर्क।
प्रश्न 7.
ठोस A, अत्यधिक कठोर तथा ठोस एवं गलित अवस्थाओं में विद्युतरोधी है और अत्यन्त उच्च दाब पर पिघलता है। यह किस प्रकार का ठोस है?
उत्तर
सहसंयोजी अथवा नेटवर्क ठोस, जैसे- SiC
प्रश्न 8.
आयनिक ठोस गलित अवस्था में विद्युत चालक होते हैं, परन्तु ठोस अवस्था में नहीं। व्याख्या कीजिए।
उत्तर
गलित अवस्था में आयनिक यौगिक वियोजित होकर मुक्त आयन देते हैं तथा विद्युत चालन करते हैं। ठोस अवस्था में आयन गति करने के लिए मुक्त नहीं होते हैं। अत: ये ठोस अवस्था में विद्युत चालन नहीं करते हैं।
प्रश्न 9.
किस प्रकार के ठोस विद्युत चालक, आघातवर्थ्य और तन्य होते हैं?
उत्तर
धात्विक ठोस।
प्रश्न 10.
‘जालक बिन्द’ से क्या तात्पर्य है?
उत्तर
प्रत्येक जालक बिन्दु ठोस के एक अवयवी कण को प्रदर्शित करता है। अवयवी कण परमाणु, अणु या आयन हो सकते हैं। किसी विशेष क्रिस्टलीय ठोस की आकृति के लिए जालक बिन्दु उत्तरदायी होते हैं।
प्रश्न 11.
एकक कोष्ठिका को अभिलक्षणित करने वाले पैरामीटरों के नाम बताइए।
उत्तर
- एकक कोष्ठिका की कोर की विमाएँ (a, b,c) – परस्पर लम्बवत् हो सकती हैं अथवा नहीं।
- कोरों के मध्य के कोण (a,B तथा γ)
प्रश्न 12.
निम्नलिखित में विभेद कीजिए –
- षट्कोणीय और एकनताक्ष एकक कोष्ठिका
- फलक केन्द्रित तथा अंत्य-केन्द्रित एकक कोष्ठिका।
उत्तर
- षट्कोणीय एकक कोष्ठिका में,
a = b ≠ c; α = β = 90° तथा γ = 120°
एकनताक्ष एकक कोष्ठिका में
a ≠ b ≠ c तथा α = γ = 90° तथा β = 90° - fcc में अवयवी कण सभी 8 कोनों एवं सभी 6 फलकों के केन्द्रों पर व्यवस्थित होते हैं। अंत्य- केन्द्रित एकक कोष्ठिका में अवयवी कण सभी 8 कोनों तथा दो विपरीत फलकों के केन्द्रों पर स्थित होते हैं।
प्रश्न 13.
स्पष्ट कीजिए कि एक घनीय एकक कोष्ठिका के
- कोने और
- अन्तःकेन्द्र पर उपस्थित परमाणु का कितना भाग सन्निकट कोष्ठिका से सहभाजित होता है?
उत्तर
- कोने पर उपस्थित परमाणु 8 एकक कोष्ठिकाओं से सहभाजित होता है। अतः एक एकक कोष्ठिका के लिए इसका योगदान 1/8 होता है।
- अन्त:केन्द्र पर उपस्थित परमाणु किसी भी अन्य एकक कोष्ठिका द्वारा सहभाजित नहीं होता है।
प्रश्न 14.
एक अणु की वर्ग निविड संकुलित परत में द्विविमीय उप-सहसंयोजन संख्या क्या होगी?
उत्तर
द्विविमीय निविड संकुलित परत में परमाणु 4 सन्निकट परमाणुओं को स्पर्श करता है अत: इसकी उप-सहसंयोजन संख्या 4 होगी।
प्रश्न 15.
एक यौगिक षट्कोणीय निविड़ संकुलित संरचना बनाता है। इसके 0.5 मोल में रिक्तियों की संख्या कितनी होगी? उनमें से कितनी रिक्तियाँ चतुष्फलकीय हैं?
हल
यौगिक के 0.5 मोल में परमाणुओं की संख्या = 0.5 x 6.022 x 1023
= 3.011 x 1023
अष्टफलकीय रिक्तियों की संख्या = संकुलन में परमाणुओं की संख्या
= 3.011 x 1023
चतुष्फलकीय रिक्तियों की संख्या = 2 x संकुलन में परमाणुओं की संख्या
= 2 x 3.011 x 1023 = 6.022 x 1023
∴ रिक्तियों की कुल संख्या = (3.011 + 6.022) x 1023
= 9.033 x 1023
प्रश्न 16.
एक यौगिक दो तत्त्वों M तथा N से बना है। तत्त्व N, ccp संरचना बनाता है और M के परमाणु चतुष्फलकीय रिक्तियों के 1/3 भाग को अध्यासित करते हैं। यौगिक का सूत्र क्या है।
हल
माना ccp में N परमाणु = n
∴ चतुष्फलकीय रिक्तियों की संख्या = 2n
चूँकि M परमाणु चतुष्फलकीय रिक्तियों का 1/3 भाग घेरते हैं।
अतः M परमाणुओं की संख्या =
M : N = : n = 2 : 3
अत: सूत्र M2N2 होगा।
प्रश्न 17.
निम्नलिखित में से किस जालक में उच्चतम संकुलन क्षमता है?
- सरल घनीय,
- अन्तः केन्द्रित घन और
- षट्कोणीय निविड संकुलित जालक।
उत्तर
संकुलन क्षमताएँ निम्न हैं –
- सरल घनीय = 52.4%,
- अन्तः केन्द्रित घनीय = 68%,
- षट्कोणीय निविड संकुलित = 74%
अतः षट्कोणीय निविड संकुलित व्यवस्था में अधिकतम संकुलन क्षमता होती है।
प्रश्न 18.
एक तत्त्व का मोलर द्रव्यमान 2.7 x 10-2 kg mol-1 है। यह 405 pm लम्बाई की भुजा वाली घनीय एकक कोष्ठिका बनाता है। यदि उसका घनत्व 2.7 x 103 kg m-3 हो तो घनीय एकक कोष्ठिका की प्रकृति क्या होगी?
हल

चूँकि प्रति एकक कोष्ठिका में तत्त्व के चार परमाणु हैं, अत: घनीय एकक कोष्ठिका फलक-केन्द्रित (fcc) या घनीय निविड संकुलित होगी।
प्रश्न 19.
जब एक ठोस को गर्म किया जाता है तो किस प्रकार का दोष उत्पन्न हो सकता है? इससे कौन-से भौतिक गुण प्रभावित होते हैं और किस प्रकार?
उत्तर
रिक्तिका दोष; गर्म करने पर ठोस के कुछ परमाणु अथवा आयन जालक स्थल को पूर्णतः छोड़ देते। हैं। परमाणुओं अथवा आयनों के क्रिस्टल को पूर्णतः छोड़ने के कारण पदार्थ का घनत्व कम हो जाता है।
प्रश्न 20.
निम्नलिखित किस प्रकार का स्टॉइकियोमीट्री दोष दर्शाते हैं?
- ZnS
- AgBr
उत्तर
- फ्रेंकेल दोष
- फ्रेंकेल तथा शॉटकी दोष दोनों।
प्रश्न 21.
समझाइए कि एक उच्च संयोजी धनायन को अशुद्धि की तरह मिलाने पर आयनिक ठोस में रिक्तिकाएँ किस प्रकार प्रविष्ट होती हैं?
उत्तर
विद्युत उदासीनता बनाए रखने के लिए उच्च संयोजकता वाले धनायन द्वारा निम्न संयोजकता वाले दो या अधिक धनायन प्रतिस्थापित होते हैं। अत: कुछ धनायन रिक्तियाँ जनित होती हैं, जैसे- यदि आयनिक ठोस Na+ cl– में Sr2+ की अशुद्धि मिलाई जाती है तब दो Na+ जालक बिन्दु रिक्त हो जाते हैं तथा इनमें से एक Sr2+ आयन द्वारा घिर जाती है तथा अन्य रिक्त रहती हैं।
प्रश्न 22.
जिन आयनिक ठोसों में धातु आधिक्य दोष के कारण ऋणायनिक रिक्तिका होती हैं, वे रंगीन होते हैं। उपयुक्त उदाहरण की सहायता से समझाइए।
उत्तर
इसको सोडियम क्लोराइड (Na+ cl–) का उदाहरण लेकर समझा सकते हैं। जब इसके क्रिस्टलों को सोडियम वाष्प की उपस्थिति में गर्म करते हैं तब कुछ Cl– आयन अपने जालक स्थलों को छोड़कर सोडियम से संयुक्त होकर NaCl बना लेते हैं। इस अभिक्रिया के होने के लिए सोडियम परमाणु इलेक्ट्रॉन खोकर Na+ आयन बनाते हैं। ये इलेक्ट्रॉन क्रिस्टल में विसरित होकर Cl– आयनों द्वारा जनित ऋणायनिक रिक्तिकाओं को घेर लेते हैं। क्रिस्टल में अब सोडियम का आधिक्य होता है। अयुग्मित इलेक्ट्रॉनों द्वारा घेरे गए स्थल F- केन्द्र कहलाते हैं। ये क्रिस्टल को पीला रंग प्रदान करते हैं, क्योंकि वे दृश्य प्रकाश की ऊर्जा का अवशोषण करके उत्तेजित हो जाते हैं।
प्रश्न 23.
वर्ग 14 के तत्त्व को n- प्रकार के अर्द्धचालक में उपयुक्त अशुद्धि द्वारा अपमिश्रित करके रूपान्तरित करना है। यह अशुद्धि किस वर्ग से सम्बन्धित होनी चाहिए?
उत्तर
अशुद्धि वर्ग 15 से सम्बन्धित होनी चाहिए।
प्रश्न 24.
किस प्रकार के पदार्थों से अच्छे स्थायी चुम्बक बनाए जा सकते हैं-
लौहचुम्बकीय अथवा फेरीचुम्बकीय? अपने उत्तर का औचित्य बताइए।
उत्तर
लौहचुम्बकीय पदार्थ श्रेष्ठ स्थायी चुम्बक बनाते हैं क्योंकि इनमें धातु आयन छोटे क्षेत्रों में व्यवस्थित होते हैं, जिन्हें डोमेन कहते हैं। प्रत्येक डोमेन सूक्ष्म चुम्बक के रूप में कार्य करता है। ये डोमेन अनियमित रूप में व्यवस्थित होते हैं। जब इन पर चुम्बकीय क्षेत्र आरोपित किया जाता है तब वे चुम्बकीय क्षेत्र की दिशा में व्यवस्थित हो जाते हैं तथा प्रबल चुम्बकीय क्षेत्र बनाते हैं। बाह्य चुम्बकीय क्षेत्र के हटा लेने पर भी डोमेन व्यवस्थित रहते हैं। इस प्रकार लौहचुम्बकीय पदार्थ स्थायी चुम्बक में परिवर्तित हो जाता है।
अतिरिक्त अभ्यास
प्रश्न 1.
‘अक्रिस्टलीय पद को परिभाषित कीजिए। अक्रिस्टलीय ठोसों के कुछ उदाहरण दीजिए।
उत्तर
ऐसे ठोस जिनका निश्चित ज्यामितीय आकार या विन्यास नहीं होता है अर्थात् इनके अवयवी कण निश्चित क्रम में व्यवस्थित नहीं होते हैं, अक्रिस्टलीय ठोस (amorphous solids) कहलाते हैं। इनका कोई निश्चित गलनांक नहीं होता है तथा ये समदैशिक (isotropic) होते हैं; जैसे, प्लास्टिक, काँच आदि।
प्रश्न 2.
काँच, क्वार्टज जैसे ठोस से किस प्रकार भिन्न है? किन परिस्थितियों में क्वार्टज को काँच में रूपान्तरित किया जा सकता है?
उत्तर
काँच अक्रिस्टलीय ठोस है। इसमें अवयवी कणों (SiO4 चतुष्क) की केवल लघु परासी व्यवस्था होती है। दूसरी ओर क्वार्ट्ज में अवयवी कणों (SiO4 चतुष्क) की लघु और दीर्घ (दोनों) परासी व्यवस्थाएँ होती हैं। दूसरे शब्दों में, क्वार्ज क्रिस्टलीय होता है।
क्वार्ट्ज़ को पिघलाकर उसे शीघ्रता से ठंडा करने पर काँच प्राप्त होता है।
प्रश्न 3.
निम्नलिखित ठोसों का वर्गीकरण आयनिक, धात्विक, आण्विक, सहसंयोजक या अक्रिस्टलीय में कीजिए।
- टेट्राफॉस्फोरस डेकॉक्साइड (P4O10)
- अमोनियम फॉस्फेट (NH4)3 PO4
- SiC
- I2
- P4
- प्लास्टिक
- ग्रेफाइट
- पीतल
- Rb
- LiBr
- Si
उत्तर
- आयनिक (Ionic) : अमोनियम फॉस्फेट (NH4)3 PO4, LiBr
- धात्विक (Metallic) : पीतल, Rb
- आण्विक (Molecular) : टेट्राफॉस्फोरस डेकॉक्साइड (P4O10), I2, P4
- सहसंयोजक (Covalent) : ग्रेफाइट, SiC, Si
- अक्रिस्टलीय (Amorphous) : प्लास्टिक
प्रश्न 4.
- उपसहसंयोजन संख्या का क्या अर्थ है?
- निम्नलिखित में परमाणुओं की उपसहसंयोजन संख्या क्या है?
- एक घनीय निविड संकुलित संरचना
- एक अन्त:केन्द्रित घनीय संरचना।
उत्तर
- उप-सहसंयोजन संख्या – यदि परमाणुओं को गोलों के रूप में प्रदर्शित किया जाए, तब किसी विशेष गोले के सन्निकट उपस्थित अन्य गोलों की संख्या उसकी उप-सहसंयोजन संख्या कहलाती है। आयनिक क्रिस्टलों में किसी आयन के चारों ओर उपस्थित विपरीत आवेशित गोलों की संख्या उसकी उप-सहसंयोजन संख्या कहलाती है।।
- 12
- 8.
प्रश्न 5.
यदि आपको किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएँ ज्ञात हैं तो क्या आप उसके परमाण्विक द्रव्यमान की गणना कर सकते हैं? स्पष्ट कीजिए।
उत्तर
परमाण्विक द्रव्यमान, M =
किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएँ ज्ञात होने पर उपर्युक्त सूत्र की सहायता से उसके परमाण्विक द्रव्यमान की गणना की जा सकती है।
प्रश्न 6.
‘किसी क्रिस्टल की स्थिरता उसके गलनांक के परिमाण द्वारा प्रकट होती है।’ टिप्पणी कीजिए। किसी आँकड़ा पुस्तक से जल, एथिल ऐल्कोहॉल, डाइएथिल ईथर तथा मेथेन के गलनांक एकत्र करें। इन अणुओं के मध्य अन्तराआण्विक बलों के बारे में आप क्या कह सकते हैं?
उत्तर
किसी पदार्थ का गलनांक जितना उच्च होता है उसके अवयवी कणों के मध्य आकर्षण बल उतना ही अधिक होता है और पदार्थ भी उतना ही अधिक स्थायी होता है। जल, एथिल ऐल्कोहॉल, डाइएथिल ईथर और मेथेन के गलनांक क्रमशः 273 K, 155.7 K, 156.8 K और 90.5 K हैं। जल और एथिल ऐल्कोहॉल में अंतराआण्विक बल हाइड्रोजन आबंधन होते हैं। जल के अणुओं के मध्य हाइड्रोजन आबंधन एथिल ऐल्कोहॉल के अणुओं की तुलना में प्रबल होता है जोकि उनके गलनांकों से भी स्पष्ट होता है। डाइएथिल ईथर के अणुओं के बीच द्विध्रुव-द्विध्रुव आकर्षण होता है तथा मेथेन अणुओं के मध्य यह दुर्बल वाण्डरवाल्स बल होता है जो कि इनके गलनांकों से स्पष्ट है।
प्रश्न 7.
निम्नलिखित युगलों के पदों (शब्दों) में कैसे विभेद करोगे?
- षट्कोणीय निविड संकुलन एवं घनीय निविड संकुलन
- क्रिस्टल जालक एवं एकक कोष्ठिका
- चतुष्फलकीय रिक्ति एवं अष्टफलकीय रिक्ति।
उत्तर
1. षट्कोणीय निविड संकुलन एवं घनीय निविड संकुलन
(Hexagonal Close Packing and Cubic Close Packing)
ये दोनों त्रिविमीय निविड संकुलित संरचनाएँ द्विविम-षट्कोणीय निविड संकुलित परतों को एक-दूसरे पर रखकर जनित की जा सकती हैं।
षट्कोणीय निविड संकुलन – जब तृतीय परत को द्वितीय परत पर रखा जाता है, तब उत्पन्न एक सम्भावना के अन्तर्गत द्वितीय परत की चतुष्फलकीय रिक्तियों को तृतीय परत के गोलों द्वारा आच्छादित किया जा सकता है। इस स्थिति में तृतीय परत के गोले प्रथम परत के गोलों के साथ पूर्णत: संरेखित होते हैं। इस प्रकार गोलों का पैटर्न एकान्तर परतों में पुनरावृत्त होता है। इस पैटर्न को प्रायः ABAB….पैटर्न लिखा जाता है। इस संरचना को षट्कोणीय निविड संकुलित (hcp) संरचना कहते हैं (चित्र-1)। इस प्रकार की परमाणुओं की व्यवस्था कई धातुओं; जैसे- मैग्नीशियम और जिंक में पायी जाती है।
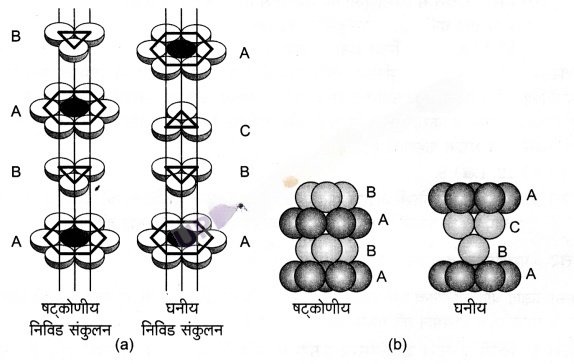
घनीय निविड संकुलन – इसके लिए तीसरी परत दूसरी परत के ऊपर इस प्रकार रखते हैं कि उसके गोले अष्टफलकीय रिक्तियों को आच्छादित करते हों। इस प्रकार से रखने पर तीसरी परत के गोले प्रथम अथवा द्वितीय किसी भी परत के साथ संरेखित नहीं होते। इस व्यवस्था को ‘C’ प्रकार का कहा जाता है। केवल चौथी परत रखने पर उसके गोले प्रथम परत के गोलों के साथ संरेखित होते हैं। जैसा चित्र-1 व 2 में दिखाया गया है। इस प्रकार के पैटर्न को प्रायः ABCABC… लिखा जाता है। इस संरचना को घनीय निविड संकुलित संरचना (ccp) अथवा फलक-केन्द्रित घनीय (fcc) संरचना कहा जाता है। धातु; जैसे- ताँबा तथा चाँदी इस संरचना में क्रिस्टलीकृत होते हैं।

उपर्युक्त दोनों प्रकार के निविड़ संकुलन अति उच्च क्षमता वाले होते हैं और क्रिस्टल का 74% स्थान सम्पूरित रहता है। इन दोनों में प्रत्येक गोला बारह गोलों के सम्पर्क में रहता है। इस प्रकार इन दोनों संरचनाओं में उपसहसंयोजन संख्या 12 है।
2. क्रिस्टल जालक एवं एकक कोष्ठिका
(Crystal Lattice and Unit Cell)
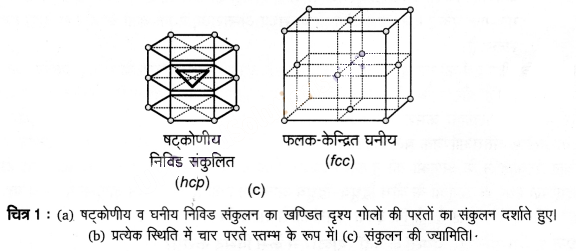
क्रिस्टल जालक – क्रिस्टलीय ठोसों का मुख्य अभिलक्षण अवयवी कणों का नियमित और पुनरावृत्त पैटर्न है। यदि क्रिस्टल में अवयवी कणों की त्रिविमीय व्यवस्था को आरेख के रूप में निरूपित किया जाए, जिसमें प्रत्येक बिन्दु को चित्रित किया गया हो तो व्यवस्था को क्रिस्टल जालक कहते हैं। इस प्रकार, “द्विकस्थान (space) में बिन्दुओं की नियमित त्रिविमीय व्यवस्था को क्रिस्टल जालक कहते हैं।”

क्रिस्टल जालक के एक भाग को चित्र- 3 में दिखाया गया है। केवल 14 त्रिविमीय जालक सम्भव हैं।
एकक कोष्ठिका – एकक कोष्ठिका क्रिस्टल जालक का लघुतम भाग है (चित्र-3)। जब इसे विभिन्न दिशाओं में पुनरावृत्त किया जाता है तो पूर्ण जालक की उत्पत्ति होती है।
3. चतुष्फलकीय रिक्ति एवं अष्टफलकीय रिक्ति
(Tetrahedral Void and Octahedral Void)
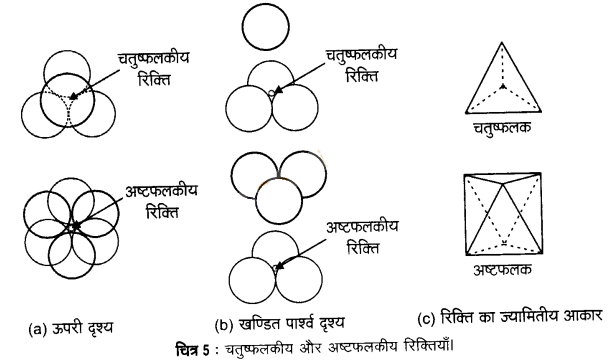
चतुष्फलकीय रिक्ति – ये रिक्तियाँ चार गोलों द्वारा घिरी रहती हैं जो एक नियमित चतुष्फलक के शीर्ष पर स्थित होते हैं। इस प्रकार जब भी द्वितीय परत का एक गोला प्रथम परत की रिक्ति के ऊपर होता है, तब एक चतुष्फलकीय रिक्ति बनती है। इन रिक्तियों को चतुष्फलकीय रिक्तियाँ इसलिए कहा जाता है। क्योंकि जब इन चार गोलों के केन्द्रों को मिलाया जाता है, तब एक चतुष्फलक बनता है। चित्र-4 में इन्हें “T’ से अंकित किया गया है। ऐसी एक रिक्ति को अलग से चित्र-5 में दिखाया गया है।
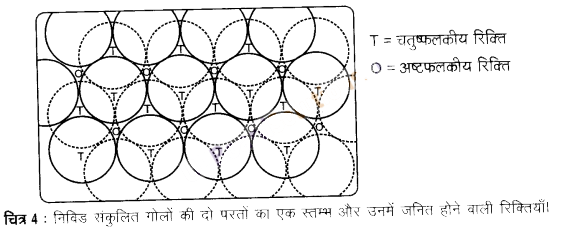
अष्टफलकीय रिक्ति – ये रिक्तियाँ सम्पर्क में स्थित तीन गोलों द्वारा संलग्नित रहती हैं। इस प्रकार द्वितीय परत की त्रिकोणीय रिक्तियाँ प्रथम परते की त्रिकोणीय रिक्तियों के ऊपर होती हैं और इनकी त्रिकोणीय आकृतियाँ अतिव्यापित नहीं होतीं। उनमें से एक में त्रिकोण का शीर्ष ऊर्ध्वमुखी और दूसरे में अधोमुखी होता है। इन रिक्तियों को चित्र-4 में ‘O’ से अंकित किया गया है। ऐसी रिक्तियाँ छह गोलों से घिरी होती हैं। ऐसी एक रिक्ति को अलग से चित्र- 5 में दिखाया गया है।
प्रश्न 8.
निम्नलिखित जालकों में से प्रत्येक की एकक कोष्ठिका में कितने जालक बिन्दु होते हैं?
- फलक-केन्द्रित घनीय,
- फलक-केन्द्रित चतुष्कोणीय,
- अन्तःकेन्द्रित।
उत्तर
- फलक-केन्द्रित घनीय संरचना (fcc) में जालक बिन्दु
= 8 (कोनों पर) + 6 (फलक केन्द्र पर) = 14 - फलक-केन्द्रित चतुष्कोणीय संरचना में जालक बिन्दु
= 8 (कोनों पर) + 6 (फलक केन्द्र पर) = 14 - अन्त:केन्द्रित घनीय (bcc) संरचना में जालक बिन्दु
= 8 (कोनों पर) + 1 (अन्त:केन्द्र पर) = 9
प्रश्न 9.
समझाइए –
- धात्विक एवं आयनिक क्रिस्टलों में समानता एवं विभेद का आधार।
- आयनिक ठोस कठोर एवं भंगुर होते हैं।
उत्तर
1. समानताएँ (Similarities) – (1) आयनिक तथा धात्विक दोनों क्रिस्टलों में स्थिर विद्युत आकर्षण बल विद्यमान होता है। आयनिक क्रिस्टलों में यह विपरीत आवेशयुक्त आयनों के मध्य होता है। धातुओं में यह संयोजी इलेक्ट्रॉनों तथा करनैल (kernels) के मध्य होता है। इसी कारण से इन दोनों के गलनांक उच्च होते हैं।
(2) दोनों स्थितियों में बन्ध अदैशिक (non-directional) होता है।
विभेद (Differences) – (1) आयनिक क्रिस्टलों में आयन गति के लिए स्वतन्त्र नहीं होते हैं। अत: ये ठोस अवस्था में विद्युत का चालन नहीं करते। ये ऐसा केवल गलित अवस्था या जलीय विलयन में करते हैं। धातुओं में संयोजी इलेक्ट्रॉन बँधे नहीं होते, अपितु मुक्त रहते हैं। अत: ये ठोस अवस्था में भी विद्युत का चालन करते हैं।
(2) आयनिक बन्ध स्थिर विद्युत आकर्षण के कारण प्रबल होते हैं। धात्विक बन्ध दुर्बल भी हो सकता है। या प्रबल भी, यह संयोजी इलेक्ट्रॉनों की संख्या तथा करनैल के आकार पर निर्भर करता है।
2. आयनिक क्रिस्टल कठोर होते हैं क्योंकि इनमें विपरीत आवेशयुक्त आयनों के मध्य प्रबल स्थिर विद्युत आकर्षण बल उपस्थित होता है। ये भंगुर होते हैं क्योंकि आयनिक बन्ध अदिशात्मक होता है।
प्रश्न 10.
निम्नलिखित के लिए धातु के क्रिस्टल में संकुलन क्षमता की गणना कीजिए।
- सरल घनीय,
- अन्त:केन्द्रित घनीय,
- फलक-केन्द्रित घनीय।
(यह मानते हुए कि परमाणु एक-दूसरे के सम्पर्क में हैं।)
उत्तर
1. सरल घनीय जालक में संकुलन क्षमता
(Packing Efficiency in Simple Cubic Lattice)
सरल घनीय जालक में परमाणु केवल घन के कोनों पर उपस्थित होते हैं। घन के किनारों (कोरों) पर कण एक-दूसरे के सम्पर्क में होते हैं (चित्र-6)। इसलिए घन के कोर अथवा भुजा की लम्बाई ‘a’ और प्रत्येक कण का अर्द्धव्यास r निम्नलिखित प्रकार से सम्बन्धित होता है –

a = 2r
घनीय एकक कोष्ठिका का आयतन = a3 = (2r)3 = 8r3
चूँकि सरल घनीय एकक कोष्ठिका में केवल 1 परमाणु होता है।
अतः अध्यासित दिक्स्थान का आयतन = 4/3 πr3
∴ संकुलन क्षमता

2. अन्तः केन्द्रित घनीय जालक में संकुलन क्षमता
(Packing Efficiency in Body-centred Cubic Lattice)
संलग्न चित्र से यह स्पष्ट है कि केन्द्र पर स्थित परमाणु विकर्ण पर व्यवस्थित अन्य दो परमाणुओं के सम्पर्क में है।
Δ EFD में,
b2 = a2 + a2 = 2a2
b = √2a
अब Δ AFD में,
c2 = a2 + b2 = a2 + 2a2 = 3a2
c= √3a
काय विकर्ण 4r की लम्बाई 47 के बराबर है, जहाँ r गोले (परमाणु) का अर्द्धव्यास है क्योंकि विकर्ण पर उपस्थित तीनों गोले एक-दूसरे के सम्पर्क में हैं। अतः
√3a = 4r
a = r
अतः यह भी लिख सकते हैं कि r = a
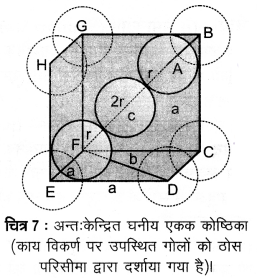
इस प्रकार की संरचना में परमाणुओं की कुल संख्या 2 है तथा उनका आयतन 2 x (4/3) πr3 है।

3. फलक-केन्द्रित घनीय जालक में संकुलन क्षमता
(Packing Efficiency in Face-centred Cubic Lattice)
संलग्न चित्र से, Δ ABC में,
AC2 = b2 = BC2 + AB2
= a2 + a2 = 2a2
या b = √2a
यदि गोले का अर्द्धव्यास r हो तो
b= 4r = √2a
या a = = 2√2r
या r =
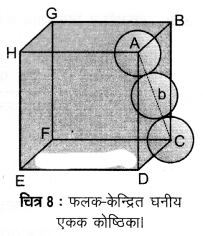
इस प्रकार की संरचना में परमाणुओं की कुल संख्या चार होती है तथा उनका आयतन 4 x πr3 है।

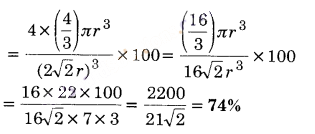
प्रश्न 11.
चाँदी का क्रिस्टलीकरण fcc जालक में होता है। यदि इसकी कोष्ठिका के कोरों की लम्बाई 4.07 x 10-8 cm तथा घनत्व 10.5 g cm-3 हो तो चाँदी का परमाण्विक द्रव्यमान ज्ञात कीजिए।
हल
fcc जालक के लिए Z = 4
कोर की लम्बाई, a = 4.077 x 10-8 cm, घनत्व ρ = 10.5 g cm-3
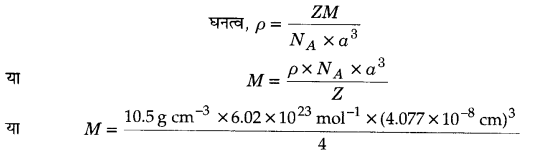
=107.14 g mol-1
अतः चाँदी का परमाण्विक द्रव्यमान = 107.14 g mol-1 होगा।
प्रश्न 12.
एक घनीय ठोस दो तत्वों P एवं Q से बना है। घन के कोनों पर Q परमाणु एवं अन्तःकेन्द्र पर P परमाणु स्थित हैं। इस यौगिक का सूत्र क्या है? P एवं Q की उपसहसंयोजन संख्या क्या है?
हल
घन में परमाणु Q, 8 कोनों पर स्थित हैं।
Q परमाणुओं की संख्या = 1/8 x 8= 1
परमाणु P अन्त: केन्द्र पर स्थित है,
अतः P परमाणुओं की संख्या = 1
अतः यौगिक का सूत्र = PQ
P तथा Q की उप-सहसंयोजन संख्या = 8
प्रश्न 13.
नायोबियम का क्रिस्टलीकरण अन्तःकेन्द्रित घनीय संरचना में होता है। यदि इसका घनत्व 8.55 g cm-3 हो तो इसके परमाण्विक द्रव्यमान 93u का प्रयोग करके परमाणु त्रिज्या की गणना कीजिए।
हल
अन्त: केन्द्रित घनीय संरचना (bcc) में Z = 2, घनत्व ρ = 8.55 g cm-3, परमाण्विक द्रव्यमान,
M = 92.9 g mol-1

∴ a = (36.1 x 10-24 cm3)1/3 = 3.3 x 10-8 cm
bcc एकक कोष्ठिका के लिए,
विकर्ण = 4 x नायोबियम परमाणु की त्रिज्या
√3a = 4 x नायोबियम परमाणु की त्रिज्या
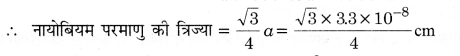
= 1.43 x 10-8 cm
प्रश्न 14.
यदि अष्टफलकीय रिक्ति की त्रिज्या हो तथा निविड संकुलन में परमाणुओं की त्रिज्या हो तो r एवं R में सम्बन्ध स्थापित कीजिए।
हल
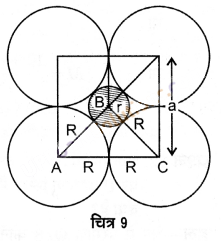
अष्टफलकीय रिक्ति में स्थित गोला चित्र 9 में छायांकित वृत्त द्वारा प्रदर्शित है। रिक्ति के ऊपर तथा नीचे उपस्थित गोले चित्र-9 में प्रदर्शित नहीं हैं। अब चूंकि ABC एक समकोण त्रिभुज है, अत: पाइथागोरस सिद्धान्त लागू करने पर,
AC2 = AB2 + BC2
(2R)2 = (R + r)2 + (R + r)2
= 2(R + r)2
4R2 = 2(R + r)2
(√2R)2 = (R + r)2
√2R = R + r
r = √2R – R
r = (√2 – 1)R
r = (1.414 – 1)R
r = 0.414 R
प्रश्न 15.
कॉपर fcc जालक के रूप में क्रिस्टलीकृत होता है जिसके कोर की लम्बाई 3.61 x 10-8 cm है। यह दर्शाइए कि गणना किए गए घनत्व के मान तथा मापे गए घनत्व 8.92 g cm-3 में समानता है।
हल
fcc जालक में Z = 4, कोर की लम्बाई, a = 3.61 x 10-8 cm, घनत्व ρ = ?
कॉपर का परमाण्विक द्रव्यमान, M = 63.5 g mol-1
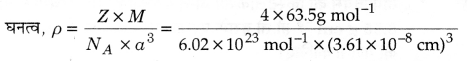
= 8.97 g cm-3
अतः घनत्व का गणनात्मक मान 8.97 g cm-3 तथा मापे गये घनत्व का मान 8.92 g cm-3 लगभग समान हैं।
प्रश्न 16.
विश्लेषण द्वारा ज्ञात हुआ कि निकिल ऑक्साइड का सूत्र Ni0.98 O1.00 है। निकिल आयनों का कितना अंश Ni2+ और Ni3+ के रूप में विद्यमान है?
हल
Ni0.98 O1.00 नॉन- स्टॉइकियोमीटी यौगिक है। Ni आयन तथा ऑक्साइड आयनों का संघटन 98 : 100 है। माना Ni में x Ni2+ आयन तथा (98 – x) Ni3+ आयन हैं।
Ni2+ तथा Ni3+ पर उपस्थित धनावेश ऑक्साइड आयनों पर उपस्थित ऋणावेश के बराबर होगा, अतः
x × 2 + (98 – x )3 = 100 x 2
2 + 294 – 3x = 100 × 2
∴ x = 94
अत: 98 Ni आयनों में 94 Ni2+ आयन तथा 4 Ni3+ आयन होंगे।
∴ Ni2+ आयनों का प्रतिशत = x 100= 96%
Ni3+ आयनों का प्रतिशत = 4%
प्रश्न 17.
अर्द्धचालक क्या होते हैं? दो मुख्य अर्द्धचालकों का वर्णन कीजिए एवं उनकी चालकता क्रियाविधि में विभेद कीजिए।
उत्तर
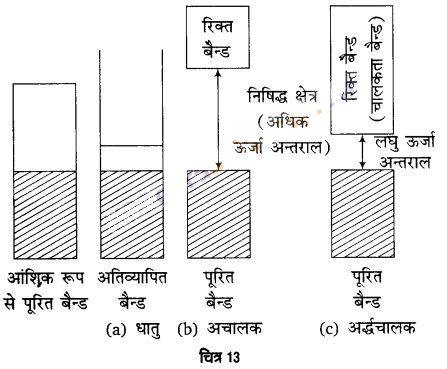
अर्द्धचालक (Semiconductors) – वे ठोस जिनकी चालकता 10-6 से 104 ohm-1 m-1 तक के मध्यवर्ती परास में होती है, अर्द्धचालक कहलाते हैं।
अर्द्धचालकों में संयोजक बैण्ड एवं चालक बैण्ड के मध्य ऊर्जा- अन्तराल कम होता है। अतः कुछ इलेक्ट्रॉन चालक बैण्ड में लाँघ सकते हैं और अल्प- चालकता प्रदर्शित कर सकते हैं। ताप बढ़ने के साथ अर्द्धचालकों में विद्युत- चालकता बढ़ती है, क्योंकि अधिक संख्या में इलेक्ट्रॉन चालक बैण्ड में देखे जा सकते हैं। सिलिकन एवं जर्मेनियम जैसे पदार्थ इस प्रकार का व्यवहार प्रदर्शित करते हैं। इनमें उचित अशुद्धि को उपयुक्त मात्रा में मिलाने से इनकी चालकता बढ़ जाती है। इस आधार पर दो प्रकार के अर्द्धचालक तथा उनकी चालकता- क्रियाविधि का वर्णन निम्नवत् है –

(i) n- प्रकार के अर्द्धचालक (n-type semiconductors) – सिलिकन तथा जर्मेनियम आवर्त सारणी के वर्ग 14 से सम्बन्धित हैं और प्रत्येक में चार संयोजक इलेक्ट्रॉन हैं। क्रिस्टलों में इनका प्रत्येक परमाणु अपने निकटस्थ परमाणुओं के साथ चार सहसंयोजक बन्ध बनाता है [चित्र-11 (a)]। जब वर्ग 15 के तत्व; जैसे- P अथवा As, जिनमें पाँच संयोजक इलेक्ट्रॉन होते हैं, को अपमिश्रित किया जाता है तो ये सिलिकन अथवा जर्मेनियम के क्रिस्टल में कुछ जालक स्थलों में आ जाते हैं [चित्र-11 (b)]। P अथवा As के पाँच में से चार इलेक्ट्रॉनों का उपयोग चार सन्निकट सिलिकन परमाणुओं के साथ चार सहसंयोजक बन्ध बनाने में होता है। पाँचवाँ अतिरिक्त इलेक्ट्रॉन विस्थानित (delocalised) हो जाता है। यह विस्थानित इलेक्ट्रॉन अपमिश्रित सिलिकन (अथवा जर्मेनियम) की चालकता में वृद्धि करता है। यहाँ चालकता में वृद्धि ऋणावेशित इलेक्ट्रॉन के कारण होती है, अत: इलेक्ट्रॉन-धनी अशुद्धि से अपमिश्रित सिलिकन को n-प्रकार का अर्द्धचालक कहा जाता है।
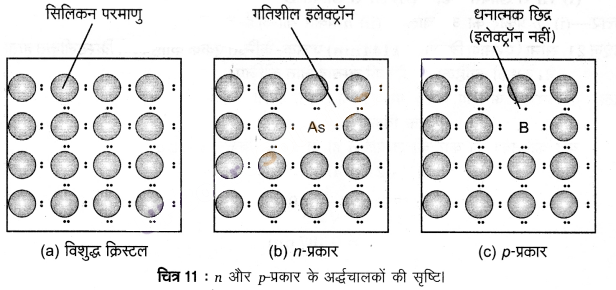
(ii) p- प्रकार के अर्द्धचालक (p-type semiconductors) – सिलिकन अथवा जर्मेनियम को वर्ग 13 के तत्वों; जैसे- B, Al अथवा Ga के साथ भी अपमिश्रित किया जा सकता है जिनमें केवल तीन संयोजक इलेक्ट्रॉन होते हैं। वह स्थान जहाँ चौथा इलेक्ट्रॉन नहीं होता, इलेक्ट्रॉन रिक्ति या इलेक्ट्रॉन छिद्र कहलाता है [चित्र-11 (c)]। निकटवर्ती परमाणु से इलेक्ट्रॉन आकर इलेक्ट्रॉन छिद्र को भर सकता है, परन्तु ऐसा करने पर वह अपने मूल स्थान पर इलेक्ट्रॉन छिद्र छोड़ जाता है। यदि ऐसा हो तो यह प्रतीत होगा जैसे कि इलेक्ट्रॉन छिद्र जिस इलेक्ट्रॉन द्वारा यह भरा गया है, उसके विपरीत दिशा में चल रहा है। विद्युत क्षेत्र के प्रभाव में इलेक्ट्रॉन, इलेक्ट्रॉन छिद्रों में से धनावेशित प्लेट की ओर चलेंगे, परन्तु ऐसा प्रतीत होगा; जैसे इलेक्ट्रॉन छिद्र धनावेशित हैं और ऋणावेशित प्लेट की ओर चल रहे हैं। इस प्रकार के अर्द्धचालकों को p- प्रकार के अर्द्धचालक कहते हैं।
प्रश्न 18.
नॉनस्टॉइकियोमीट्री क्यूप्रस ऑक्साइड, Cu2O प्रयोगशाला में बनाया जा सकता है। इसमें कॉपर तथा ऑक्सीजन का अनुपात 2 : 1 से कुछ कम है। क्या आप इस तथ्य की व्याख्या कर सकते हैं कि यह पदार्थ p- प्रकार का अर्द्धचालक है?
उत्तर
Cu2O में Cu तथा O का 2 : 1 से कम अनुपात यह प्रदर्शित करता है कि इसमें धनायनिक रिक्ति के कारण धातु न्यूनता (metal deficiency) है। धातु न्यून यौगिक धनायन छिद्रों के द्वारा विद्युत चालन करते हैं। अतः p- प्रकार के अर्द्धचालक (p- type semiconductors) होते हैं।
प्रश्न 19.
फेरिक ऑक्साइड में ऑक्साइड आयन के षट्कोणीय निविड़ संकुलन में क्रिस्टलीकृत होता है जिसकी तीन अष्टफलकीय रिक्तियों में से दो पर फेरिक आयन उपस्थित होते हैं। फेरिक ऑक्साइड का सूत्र ज्ञात कीजिए।
हल
माना निविड संकुलित संरचना में ऑक्साइड (O2-) आयनों की संख्या = x
∴ अष्टफलकीय रिक्तियों की संख्या = x
∴ इन रिक्तियों का 2/3 भाग फेरिक आयनों (Fe3+) द्वारा भरा है।
अत: उपस्थित Fe3+ आयनों की संख्या 2/3 × x = 2x/3
Fe3+ : O2- = 2x/3 : x = 2 : 3
अतः फेरिक ऑक्साइड का सूत्र Fe2O3 होगा।
प्रश्न 20.
निम्नलिखित को p-प्रकार या n-प्रकार के अर्द्धचालकों में वर्गीकृत कीजिए –
- In से डोपित Ge,
- Si से डोपित B
उत्तर
- p- प्रकार का अर्द्धचालक,
- n- प्रकार का अर्द्ध-चालक।
प्रश्न 21.
सोना (परमाणु त्रिज्या= 0.144 nm) फलक-केन्द्रित एकक कोष्ठिका में क्रिस्टलीकृत होता है। इसकी कोष्ठिका के कोर की लम्बाई ज्ञात कीजिए।
हल
fcc संरचना के लिए यदि r परमाणु की त्रिज्या हो तो
फलक विकर्ण = 4r
यदि कोष्ठिका की कोर की लम्बाई a हो तो फलक विकर्ण = √2a
अतः √2a = 4r
∴ a = × 0.144
0.407 nm
प्रश्न 22.
बैण्ड सिद्धान्त के आधार पर
- चालक एवं रोधी
- चालक एवं अर्द्धचालक में क्या अन्तर होता है?
उत्तर
- चालक एवं रोधी में अन्तर (Difference between conductor and insulator) – अचालक अथवा रोधी में संयोजक बैण्ड तथा चालक बैण्ड के मध्य ऊर्जा-अन्तर बहुत अधिक होता है, जबकि चालक में ऊर्जा-अन्तर अत्यन्त कम होता है या संयोजक बैण्ड तथा चालक बैण्ड के बीच अतिव्यापन होता है।
- चालक एवं अर्द्धचालक में अन्तर (Difference between conductor and semiconductor) – चालक में संयोजक बैण्ड तथा चालक बैण्ड के बीच ऊर्जा-अन्तर अत्यन्त कम होता है। अथवा अतिव्यापन होता है, जबकि अर्द्धचालकों में ऊर्जा अन्तर सदैव कम ही होता है, कभी भी अतिव्यापन नहीं होता।
प्रश्न 23.
उचित उदाहरणों द्वारा निम्नलिखित पदों को परिभाषित कीजिए
- शॉट्की दोष
- फ्रेंकेल दोष
- अन्तराकाशी
- F-केन्द्र।
उत्तर
1. शॉट्की दोष (Schottky defect) – यह आधारभूत रूप से आयनिक ठोसों का रिक्तिका दोष है। जब एक परमाणु अथवा आयन अपनी सामान्य (वास्तविक) स्थिति से लुप्त हो जाता है तो एक जालक रिक्तता निर्मित हो जाती है; इसे शॉकी दोष कहते हैं। विद्युत उदासीनता को बनाए रखने के लिए लुप्त होने वाले धनायनों और ऋणायनों की संख्या बराबर होती है। शॉट्की दोष उन आयनिक पदार्थों द्वारा दिखाया जाता है जिनमें धनायन और ऋणायन लगभग समान आकार के होते हैं। उदाहरण के लिए– NaCl, KCl, CsCl और AgBr शॉट्की दोष दिखाते हैं।
2. फ्रेंकेल दोष (Frenkel defect) – यह दोष आयनिक ठोसों द्वारा दिखाया जाता है। लघुतर आयन (साधारणतया धनायन) अपने वास्तविक स्थान से विस्थापित होकर अन्तराकाश में चला जाता है। यह वास्तविक स्थान पर रिक्तिका दोष और नए स्थान पर अन्तराकाशी दोष उत्पन्न करता है। फ्रेंकेल दोष को विस्थापन दोष भी कहते हैं। यह ठोस के घनत्व को परिवर्तित नहीं करता। फ्रेंकेल दोष उन आयनिक पदार्थ द्वारा दिखाया जाता है जिनमें आयनों के आकार में अधिक अन्तर होता है। उदाहरण के लिए– ZnS, AgCl, AgBr और AgI में यह दोष Zn2+ और Ag+ आयन के लघु आकार के कारण होता है।
3. अन्तराकाशी दोष (Interstitial defect) – जब कुछ अवयवी कण (परमाणु अथवा अणु) अन्तराकोशी स्थल पर पाए जाते हैं तब उत्पन्न दोष अन्तराकाशी दोष कहलाता है। यह दोष पदार्थ के घनत्व को बढ़ाता है। अन्तराकाशी दोष अनआयनिक ठोसों में पाया जाता है। आयनिक ठोसों में सदैव विद्युत उदासीनता बनी रहनी चाहिए। इससे इनमें यह दोष दिखाई नहीं देता है।
4. F-केन्द्र (F-centre) – जब क्षारकीय हैलाइड; जैसे- NaCl को क्षार धातु (जैसे- सोडियम) की वाष्प के वातावरण में गर्म किया जाता है तो सोडियम परमाणु क्रिस्टल की सतह पर जम जाते हैं। Cl– आयन क्रिस्टल की सतह में विसरित हो जाते हैं और Na+ आयनों के साथ जुड़कर NaCl देते हैं। Na+ आयन बनाने के लिए Na परमाणु से एक इलेक्ट्रॉन निकल जाता है। निर्मुक्त इलेक्ट्रॉन विसरित होकर क्रिस्टल के ऋणायनिक स्थान को अध्यासित करते हैं, परिणामस्वरूप अब क्रिस्टल में सोडियम का आधिक्य होता है। अयुग्मित इलेक्ट्रॉनों द्वारा भरी जाने वाली इन ऋणायनिक रिक्तिकाओं को F-केन्द्र कहते हैं। ये NaCl क्रिस्टलों को पीला रंग प्रदान करते हैं। यह रंग इन इलेक्ट्रॉनों द्वारा क्रिस्टल पर पड़ने वाले प्रकाश से ऊर्जा अवशोषित करके उत्तेजित होने के परिणामस्वरूप दिखता है।
प्रश्न 24.
ऐलुमिनियम घनीय निविड संकुलित संरचना में क्रिस्टलीकृत होता है। इसका धात्विक अर्द्धव्यास 125 pm है।
- एकक कोष्ठिका के कोर की लम्बाई ज्ञात कीजिए।
- 1.0 cm3 ऐलुमिनियम में कितनी एकक कोष्ठिकाएँ होंगी?
हल
घनीय निविड संकुलित संरचना में fcc संरचना होती है।
अतः फलक विकर्ण a√2 = 4r
1. ऐलुमिनियम की एकक कोष्ठिका की कोर की लम्बाई
a = × 125 pm = 353.5 pm
2. Al के 1 cm3 में एकक कोष्ठिकाओं की संख्या

प्रश्न 25.
यदि NaCl को SrCl2 के 10-3 मोल % से डोपित किया जाए तो धनायनों की रिक्तियों का सान्द्रण क्या होगा?
हल

प्रश्न 26.
निम्नलिखित को उचित उदाहरणों से समझाइए –
- लौहचुम्बकत्व
- अनुचुम्बकत्व
- फेरीचुम्बकत्व
- प्रतिलौहचुम्बकत्व
- 12 – 16 और 13 – 15 वर्गों के यौगिक।
उत्तर
1. लौहचुम्बकत्व (Ferromagnetism) – कुछ पदार्थ; जैसे-लोहा, कोबाल्ट, निकिल, गैडोलिनियम और CrO2 बहुत प्रबलता से चुम्बकीय क्षेत्र की ओर आकर्षित होते हैं। ऐसे पदार्थों को लौहचुम्बकीय पदार्थ कहा जाता है। प्रबल आकर्षणों के अतिरिक्त ये स्थायी रूप से चुम्बकित किए जा सकते हैं। ठोस अवस्था में लौहचुम्बकीय पदार्थों के धातु आयन छोटे खण्डों में एकसाथ समूहित हो जाते हैं, इन्हें डोमेन कहा जाता है। इस प्रकार प्रत्येक डोमेन एक छोटे चुम्बक की भाँति व्यवहार करता है। लौहचुम्बकीय पदार्थ के अचुम्बकीय टुकड़े में डोमेन अनियमित रूप से अभिविन्यसित होते हैं और उनकी चुम्बकीय आघूर्ण निरस्त हो जाता है। पदार्थ को चुम्बकीय क्षेत्र में रखने पर सभी डोमेन चुम्बकीय क्षेत्र की दिशा में अभिविन्यसित हो जाते हैं (चित्र-12 (a)] और प्रबल चुम्बकीय प्रभाव उत्पन्न होती है। चुम्बकीय क्षेत्र को हटा लेने पर भी डोमेनों का क्रम बना रहता है और लौहचुम्बकीय पदार्थ स्थायी चुम्बक बन जाते हैं। चुम्बकीय पदार्थों की यह प्रवृत्ति लौहचुम्बकत्व कहलाती है।
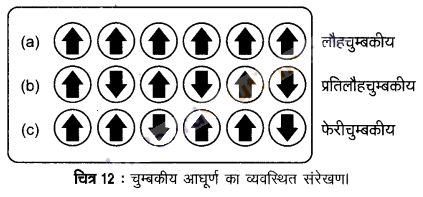
2. अनुचुम्बकत्व (Paramagnetism) – वे पदार्थ जो चुम्बकीय क्षेत्र द्वारा आकर्षित होते हैं, अनुचुम्बकीय पदार्थ कहलाते हैं। इन पदार्थों की यह प्रवृत्ति अनुचुम्बकत्व कहलाती है। अनुचुम्बकीय पदार्थ चुम्बकीय क्षेत्र की ओर दुर्बल रूप से आकर्षित होते हैं। ये चुम्बकीय क्षेत्र की दिशा में ही चुम्बकित हो जाते हैं तथा चुम्बकीय क्षेत्र की अनुपस्थिति में अपना चुम्बकत्व खो देते हैं। अनुचुम्बकत्व का कारण एक अथवा अधिक अयुग्मित इलेक्ट्रॉनों की उपस्थिति है, जो कि चुम्बकीय क्षेत्र की ओर आकर्षित होते हैं। O2, Cu2+, Fe3+, Cr3+ ऐसे पदार्थों के कुछ उदाहरण हैं।
3. फेरीचुम्बकत्व (Ferrimagnetism) – जब पदार्थ में डोमेनों के चुम्बकीय आघूर्णो का संरेखण समान्तर एवं प्रतिसमान्तर दिशाओं में असमान होता है, तब पदार्थ में फेरीचुम्बकत्व देखा जाता है। [चित्र-12 (c)]। ये लोहचुम्बकत्व की तुलना में चुम्बकीय क्षेत्र द्वारा दुर्बल रूप से आकर्षित होते हैं। Fe3O4 (मैग्नेटाइट) और फेराइट जैसे MgFe2O4, ZnFe2O4, ऐसे पदार्थों के उदाहरण हैं। ये पदार्थ गर्म करने पर फेरीचुम्बकत्व खो देते हैं और अनुचुम्बकीय बन जाते हैं।
4. प्रतिलौहचुम्बकत्व (Antiferromagnetism) – प्रतिलौहचुम्बकत्व प्रदर्शित करने वाले पदार्थ जैसे MnO में डोमेन संरचना लोहचुम्बकीय पदार्थ के समान होती है, परन्तु उनके डोमेन एक-दूसरे के विपरीत अभिविन्यसित होते हैं तथा एक-दूसरे के चुम्बकीय आघूर्ण को निरस्त कर देते हैं [चित्र-12 (b)]। जब चुम्बकीय आघूर्ण इस प्रकार अभिविन्यासित होते हैं कि नेट चुम्बकीय आघूर्ण शून्य हो जाता है, तब चुम्बकत्व प्रतिलौहचुम्बकत्व कहलाता है।
5. 12 – 16 और 13 -15 वर्गों के यौगिक (Compounds of group 12-16 and 13-15) – वर्ग 12 के तत्वों और वर्ग 16 के तत्वों से बने यौगिक 12 – 16 वर्गों के यौगिक कहलाते हैं; जैसे- ZnS, HgTe आदि।
वर्ग 13 के तत्वों और वर्ग 15 के तत्वों से बने यौगिक 13 – 15 वर्गों के यौगिक कहलाते हैं; जैसे- GaAs, AlP आदि।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
एक विशेष ठोस अति कठोर है तथा इसका गलनांक अति उच्च है। ठोस अवस्था में यह अचालक है तथा प्रगलन पर यह विद्युत चालक हो जाता है। ठोस है।
(i) धात्विक
(ii) आण्विक
(iii) नेटवर्क
(iv) आयनिक
उत्तर
(iv) आयनिक
प्रश्न 2.
किस प्रकार के ठोस विद्युत चालक, आघातवर्धनीय और तन्य होते हैं?
(i) आणिवक
(ii) आयनिक
(iii) धात्विक
(iv) सहसंयोजक
उत्तर
(iii) धात्विक
प्रश्न 3.
ठोस Aएक अति कठोर ठोस तथा गलित अवस्था में विद्युतरोधी है और बहुत उच्च ताप पर पिघलता है। यह किस प्रकार का ठोस है?
(i) आण्विक
(ii) आयनिक
(iii) धात्विक
(iv) सहसंयोजक
उत्तर
(iv) सहसंयोजक
प्रश्न 4.
ग्रेफाइट है –
(i) आयनिक ठोस
(ii) धात्विक ठोस
(iii) सहसंयोजी ठोस
(iv) आण्विक ठोस
उत्तर
(iii) सहसंयोजी ठोस
प्रश्न 5.
निम्न में से कौन-सा सहसंयोजक क्रिस्टल है?
(i) रॉक साल्ट
(ii) बर्फ
(iii) क्वार्ट्ज
(iv) शुष्क बर्फ
उत्तर
(iii) क्वार्ट्ज
प्रश्न 6.
प्लास्टिक है –
(i) आयनिक ठोस
(ii) धात्विक ठोस
(iii) सहसंयोजी ठोस
(iv) इनमें से कोई नहीं
उत्तर
(iv) इनमें से कोई नही
प्रश्न 7.
सोडियम क्लोराइड क्रिस्टल की संरचना है –
(i) फलक केन्द्रित घनीय
(ii) मोनोक्लीनिक
(iii) ऑर्थोरोम्बिक
(iv) चतुष्कोणीय
उत्तर
(i) फलक केन्द्रित घनीय
प्रश्न 8.
फलक केन्द्रित घनीय जालक में एक एकक कोष्ठिका में परमाणुओं की संख्या होगी –
(i) 2
(ii) 3
(iii) 4
(iv) 5
उत्तर
(iii) 4
प्रश्न 9.
58.5 g NaCl में एकक कोष्ठिकाओं की लगभग संख्या होगी –
(i) 1.5 x 1023
(ii) 6 x 1023
(iii) 3 x 1022
(iv) 0.5 x 1024
उत्तर
(i) 1.5 x 1023
प्रश्न 10.
Zn अपनी गलित अवस्था से ठोस अवस्था में परिवर्तित होता है जिसकी संरचना hcp प्रकार की है। समीपस्थ परमाणुओं की संख्या होगी –
(i) 6
(ii) 8
(iii) 12
(iv) 4
उत्तर
(iii) 12
प्रश्न11.
एक ठोस AB, जिसकी संरचना NaCl प्रकार की है, में A परमाणु घनीय एकक कोष्ठिका के सभी कोनों को घेरते हैं। यदि एक अक्ष के सभी फलक केन्द्रित परमाणु निष्कासित हो जायें तो ठोस की स्टॉइकियोमीट्री होगी –
(i) AB2
(ii) A2B
(iii) A4B3
(iv) A3B4
उत्तर
(iv) A3B4
प्रश्न12.
एक एकक कोष्ठिका जिसमें परमाणुओं की संख्या 2 है तथा जो ABC ABC….. संकुलन क्रम प्रदर्शित करती है, में चतुष्फलकीय रिक्तियों की संख्या होगी –
(i) Z
(ii) 2Z
(iii) Z/2
(iv) Z/4
उत्तर
(ii) 2Z
प्रश्न 13.
सोडियम क्लोराइड क्रिस्टल में Na’ आयन की समन्वय संख्या है –
(i) 6
(ii) 8
(iii) 4
(iv) 1
उत्तर
(i) 6
प्रश्न 14.
एक धातु फलक केन्द्रित घनीय जालक में क्रिस्टलित होता है। एकक कोष्ठिका की कोर की लम्बाई 408 pm है। धातु परमाणु का व्यास है
(i) 288 pm
(ii) 408 pm
(iii) 144 pm
(iv) 204 pm
उत्तर
(i) 288 pm
प्रश्न 15.
सरल घन में उपस्थित परमाणुओं द्वारा घेरे गये कुल आयतन का प्रभाव है –
(i)
(ii)
(iii)
(iv)
उत्तर
(ii)
प्रश्न 16.
एक ठोस यौगिक XY की NaCl संरचना है। यदि धनायन की त्रिज्या 100 pm है तो ऋणायन (Y–) की त्रिज्या होगी –
(i) 275.1 pm
(ii) 322.5 pm
(iii) 241.5 pm
(iv) 165.7 pm
उत्तर
(iii) 241.5 pm
प्रश्न17.
फ्रेंकेल दोष के कारण आयनिक क्रिस्टल का घनत्व –
(i) घटता है।
(ii) बढ़ता है।
(iii) परिवर्तित होता है।
(iv) अपरिवर्तित रहता है।
उत्तर
(iv) अपरिवर्तित रहता है।
प्रश्न 18.
फ्रेंकेल तथा शॉटकी दोष होते हैं –
(i) नाभिकीय दोष
(ii) क्रिस्टल दोष
(iii) परमाणु दोष
(iv) अणु दोष
उत्तर
(ii) क्रिस्टल दोष
प्रश्न 19.
शॉटकी दोष किसके जालक की अपूर्णताएँ परिभाषित करता है?
(i) गैस की
(ii) प्लाज्मा की
(iii) द्रव की
(iv) ठोस की
उत्तर
(iv) ठोस की
प्रश्न 20.
Fe3O4 का क्रिस्टल है –
(i) प्रतिचुम्बकीय
(ii) लौहचुम्बकीय
(iii) अनुचुम्बकीय
(iv) इनमें से कोई नहीं
उत्तर
(ii) लौहचुम्बकीय
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
क्रिस्टलीय ठोस क्या हैं?
उत्तर
वे ठोस जिनमें घटक कणों की दीर्घ परास व्यवस्था होती है, क्रिस्टलीय ठोस कहलाते हैं। उदाहरणार्थ– चाँदी, ताँबा, सोडियम क्लोराइड आदि।
प्रश्न 2.
अक्रिस्टलीय ठोस को परिभाषित कीजिए।
उत्तर
एक ठोस अक्रिस्टलीय कहलाता है, जब इसके अवयवी कणों की लघु परास व्यवस्था होती है।
प्रश्न 3.
आण्विक ठोस से आप क्या समझते हैं?
उत्तर
जिन ठोसों के क्रिस्टल जालक सरल विविक्त अणुओं से बने होते हैं, वे आण्विक ठोस कहलाते हैं। उदाहरणार्थ– आयोडीन, सल्फर, सफेद फास्फोरस आदि।
प्रश्न 4.
आयनिक ठोस की परिभाषा दीजिए।
उत्तर
जिन ठोसों के क्रिस्टल जालक धनायनों और ऋणायनों से बने होते हैं, वे आयनिक ठोस कहलाते हैं। उदाहरणार्थ– सोडियम क्लोराइड, धातु ऑक्साइड, धातु सल्फाइड आदि।
प्रश्न 5.
धात्विक ठोस को स्पष्ट कीजिए।
उत्तर
जो ठोस धातुओं के गुण प्रकट करते हैं, धात्विक ठोस कहलाते हैं। उदाहरणार्थ– सोना, चाँदी, ताँबा आदि।
प्रश्न 6.
सह-संयोजक ठोस से क्या अभिप्राय है?
उत्तर
जिन ठोसों के क्रिस्टल जालक परमाणुओं से बने होते हैं, वे सह-संयोजक ठोस कहलाते हैं। उदाहरणार्थ -हीरा, ग्रेफाइट, सिलिका आदि।
प्रश्न 7.
सोडियम क्लोराइड का टुकड़ा सोडियम धातु से कठोर होता है। क्यों?
उत्तर
NaCl (सोडियम क्लोराइड) में Na+ तथा Cl– के मध्य आयनिक बन्ध होता है जिसके कारण ये अपेक्षाकृत कठोर होते हैं। सोडियम धातु में धात्विक बन्ध होता है जो आयनिक बन्ध की तुलना में कमजोर होता है, इसलिए सोडियम धातु NaCl की तुलना में नर्म होता है।
प्रश्न 8.
रॉक साल्ट प्रकार की संरचना में प्रत्येक आयन की उपसहसंयोजन संख्या क्या होती है?
उत्तर
रॉक साल्ट प्रकार की संरचना में प्रत्येक आयन की उपसहसंयोजन संख्या 6 होती है।
प्रश्न 9.
आयनिक क्रिस्टलों में 12 उप-सहसंयोजन संख्या क्यों नहीं पायी जाती है?
उत्तर
घनीय रिक्तिको के निर्माण के लिए त्रिज्या अनुपात परास 0.732 से 1.0 होता है। अतः उप-सहसंयोजन संख्या 8 से अधिक नहीं हो सकती है।
प्रश्न 10.
क्या किसी दिये गये तत्त्व के षट्कोणीय निविड संकुलन तथा घनीय निविड संकुलन संरचना के घनत्व समान हो सकते हैं? समझाइए।
उत्तर
दोनों प्रकार की संरचना में घेरा गया कुल आयतन समान (74%) होता है एवं दोनों संरचनाओं में उप-सहसंयोजन संख्या 12 होती है। अतः दोनों संरचनाओं में घनत्व समान होंगे।
प्रश्न 11.
एक क्रिस्टलीय ठोस में ऑक्साइड आयन घनीय निविड संकुलन संरचना में व्यवस्थित है। धनायन A समान रूप से अष्टफलकीय तथा चतुष्फलकीय रिक्तियों में वितरित है। यदि सभी अष्टफलकीय रिक्तियाँ भरी हों तब ठोस का सूत्र क्या है?
उत्तर
ऑक्साइड आयनों की घनीय निविड संकुलन संरचना में प्रति एकक कोष्ठिका 4 ऑक्साइड आयन होने चाहिए। प्रत्येक ऑक्साइड आयन 2 चतुष्फलकीय रिक्तियों तथा एक अष्टफलकीय रिक्तियों से सम्बन्धित होता है। अत: 4 अष्टफलकीय तथा 8 चतुष्फलकीय रिक्तियाँ होनी चाहिए। चूंकि सभी अष्टफलकीय रिक्तियाँ A द्वारा घेरी जाती हैं। अत: अष्टफलेकीय रिक्तियों में 4 धनायन A होंगे तथा समान संख्या में धनायन A चतुष्फलकीय रिक्तियों में होंगे। अत: 4 ऑक्साइड आयन तथा 8 धनायन A होंगे। अतः ठोस का सूत्र A 80,या A20 होगा।
प्रश्न 12.
घनीय निविड संकुलन संरचना युक्त 1 मोल यौगिक में अष्टफलकीय रिक्तियाँ कितनी होंगी?
उत्तर
अष्टफलकीय रिक्तियों की संख्या = संकुलन में परमाणुओं की संख्या
= 1 मोल = 6.023 × 1023
प्रश्न 13.
संकुलन दक्षता (क्षमता) को परिभाषित कीजिए।
उत्तर
क्रिस्टल में उपलब्ध कुल स्थान का परमाणुओं द्वारा घेरा हुआ अंश संकुलन दक्षता कहलाता है। यह प्रायः प्रतिशत में व्यक्त की जाती है।
यदि किसी क्रिस्टल संरचना की एकक कोष्ठिका में उपस्थित परमाणुओं द्वारा कोष्ठिका का घेरा हुआ, आयतन Voccu और एकक कोष्ठिका का कुल आयतन Vcell है, तो
संकुलन क्षमता = x 100
प्रश्न 14.
किसी तत्त्व x की परमाणु त्रिज्या 3.6Å है। इसकी एकक कोष्ठिका में सन्निकट पड़ोसी कण की दूरी क्या होगी?
हल
d = 2r = 2 x 3.6 Å = 7.2 Å.
प्रश्न 15.
फ्रेंकेल दोष AgCl क्रिस्टलों के घनत्व को परिवर्तित क्यों नहीं करता है?
उत्तर
चूँकि फ्रेंकेल दोषयुक्त क्रिस्टल में आयनों की संख्या समान रहती है इसलिए यह दोष क्रिस्टलों के घनत्व में कोई परिवर्तन नहीं करता है।
प्रश्न 16.
क्रिस्टलों में कौन-सा बिन्दु दोष सम्बन्धित ठोस के घनत्व को परिवर्तित नहीं करता है?
उत्तर
फ्रेंकेल दोष।
प्रश्न 17.
फ्रेंकेल दोष उपस्थित होने पर भी क्रिस्टल के घनत्व में कोई परिवर्तन नहीं होता है, क्यों?
उत्तर
फ्रेंकेल दोष में धनायन अपने जालक बिन्दुओं से हटकर अन्तराकाशी स्थानों में आ जाते हैं, इसलिए क्रिस्टल के घनत्व में कोई परिवर्तन नहीं होता है।
प्रश्न 18.
शॉटकी तथा फ्रेंकेल दोषों का क्रिस्टल की उदासीनता पर क्या प्रभाव पड़ता है?
उत्तर
शॉटकी तथा फ्रेंकेल दोष उपस्थित होने पर क्रिस्टल उदासीन (neutral) बने रहते हैं।
प्रश्न 19.
CaCl2, AgCI क्रिस्टल में मिलाने पर शॉटकी दोष उत्पन्न करता है। व्याख्या कीजिए।
उत्तर
विद्युत उदासीनता बनाए रखने के लिए 2Ag2+ आयन 1 Ca2+ द्वारा प्रतिस्थापित होंगे। अत: प्रत्येक Ca2+ आयन के प्रवेश पर जालक स्थल में एक छिद्र उत्पन्न होता है।
प्रश्न20.
F- केन्द्र क्या है?
उत्तर
वह स्थान जहाँ ऋणायन रिक्तिका में इलेक्ट्रॉन उपस्थित होता है, F- केन्द्र कहलाता है।
प्रश्न 21.
रिक्तिका को परिभाषित कीजिए।
उत्तर
धातु परमाणुओं अथवा आयनों को जब क्रिस्टल में संकुलित किया जाता है, तब इनके मध्य उपस्थित स्थान रिक्तिका कहलाता है।
प्रश्न 22.
एक लवण का नाम लिखिए जिसे AgCl में मिलाकर धनायन रिक्तियाँ उत्पन्न की जा सकती हैं।
उत्तर
CdCl2 अथवा SrCl2
प्रश्न 23.
क्षारीय धातु हैलाइडों के रंग के लिए उत्तरदायी नॉन-स्टॉइकियोमिट्री बिन्दु दोष का नाम लिखिए।
उत्तर
धातु आधिक्य अथवा ऋणायनिक रिक्तिकाएँ अथवा F- केन्द्र।
प्रश्न 24.
आप किस प्रकार NaCl संरचना को CsCl प्रकार की संरचना में एवं CsCl को NaCl प्रकार की संरचना में परिवर्तित करेंगे?
उत्तर
CsCl प्रकार की संरचना को NaCl प्रकार की संरचना में गर्म करके तथा NaCI पर उच्च दाब आरोपित करके CSCl प्रकार की संरचना प्राप्त की जा सकती है।
प्रश्न 25.
साधारण नमक शुद्ध सफेद के स्थान पर कभी-कभी पीला दिखाई देता है? क्यों?
उत्तर
ऐसा जालक स्थलों में ऋणायनों के स्थान पर इलेक्ट्रॉनों की उपस्थिति के कारण होता है। ये स्थल F- केन्द्रों की तरह कार्य करते हैं।
प्रश्न 26.
जिंक ऑक्साइड सफेद होता है लेकिन गर्म करने पर यह पीला पड़ जाता है। समझाइए।
उत्तर
जब जिंक ऑक्साइड को गर्म किया जाता है तब यह निम्न समीकरण के अनुसार ऑक्सीजन खोता है।
ZnO → Zn2+ + 1/2 O2 + 2e–
Zn2+ अन्तराकाशी रिक्तिकाओं में व्यवस्थित हो जाते हैं तथा इलेक्ट्रॉन विद्युत उदासीनता बनाए रखने के लिए पड़ोसी अन्तराकाशी रिक्तियों में व्यवस्थित हो जाते हैं। इससे धातु आधिक्य दोष उत्पन्न होता है। अन्तराकाशी रिक्तियों में इलेक्ट्रॉनों की उपस्थिति के कारण यह पीला होता है क्योंकि इलेक्ट्रॉनों द्वारा श्वेत प्रकाश के अन्य रंगों को अवशोषित कर लिया जाता है।
प्रश्न 27.
अर्द्धचालकों की विद्युत चालकता पर ताप का क्या प्रभाव पड़ता है?
उत्तर
ताप वृद्धि से अर्द्धचालकों की विद्युत चालकता बढ़ जाती है।
प्रश्न 28.
गर्म करने पर चुम्बकीय पदार्थ अनुचुम्बकीय हो जाते हैं, क्यों?
उत्तर
गर्म करने पर इलेक्ट्रॉन चक्रण अनियमित रूप से अभिविन्यसित (aligned) हो जाने के कारण लौहचुम्बकीय पदार्थ अनुचुम्बकीय हो जाते हैं।
लघु उत्तरीय प्रश्न
प्रश्न 1.
58.5 ग्राम NaCl में इकाई सेलों की संख्या ज्ञात कीजिए।
हल

प्रश्न 2.
एक आयनिक ठोस के फलक केन्द्रित घनीय सेल के कोर की लम्बाई 508 pm है। यदि धनायन की त्रिज्या 110 pm हो, तो ऋणायन की त्रिज्या की गणना कीजिए।
हल
दिया गया है, कोर की लम्बाई = 508 pm,
धनायन की त्रिज्या (r+)= 110 pm, ऋणायन की त्रिज्या (r–)= ?
सूत्र कोर की लम्बाई = 2(r+ + r–) से,
508 /2 = r+ + r–
r+ + r– = 254
110 + r– = 254
r– = 254 – 110
r– = 144 pm
प्रश्न 3.
चाँदी घनीय संवृत संकुलन (ccp) जालक बनाती है। इसके क्रिस्टल की x – किरण जाँच से ज्ञात हुआ कि इसके एकक सेल के कोर की लम्बाई 408.6 pm है। चाँदी के घनत्व की गणना कीजिए। (चाँदी का परमाणु द्रव्यमान = 107.9)
हल
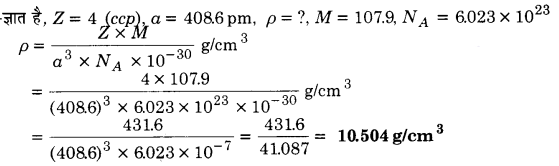
प्रश्न 4.
बैण्ड सिद्धान्त के आधार पर चालक और अर्द्धचालक पदार्थों के विद्युत गुणों को समझाइए।
उत्तर
बैन्ड सिद्धान्त के अनुसार, प्रत्येक तत्व में दो प्रकार के बैन्ड उपस्थित होते हैं, संयोजक बैन्ड तथा आगामी उच्च रिक्त बैन्ड (चालकता बैन्ड)। इन दोनों बैन्डों के मध्य की दूरी को ऊर्जा अन्तराल कहते हैं। चालकों (धातुओं) में संयोजकता बैन्ड आंशिक रूप से भरा होता है, या रिक्त चालकता बैन्ड के साथ अतिव्यापन करता है जिससे विद्युत क्षेत्र में इलेक्ट्रॉन आसानी से प्रवाहित हो सकते हैं और धातुएँ चालकता दर्शाती हैं।
अर्द्धचालकों में ऊर्जा अन्तराल कम होता है। इस कारण कुछ इलेक्ट्रॉन संयोजक बैन्ड से चालकता बैन्ड में चले जाते हैं। इस प्रकार अर्द्धचालक अल्पचालकता दर्शाते हैं। ताप बढ़ने पर अर्द्धचालकों की विद्युत चालकता बढ़ जाती है।
विद्युतरोधियों में ऊर्जा अन्तराल इतना अधिक होता है, कि इलेक्ट्रॉन इसे नहीं लाँघ सकते। अतः चालकता नहीं दर्शाते हैं।
दीर्थ शरीय प्रश्न
प्रश्न 1.
ठोसों को किस प्रकार वर्गीकृत किया जाता है? प्रत्येक प्रकार के अवयवी कण के बारे में समझाइए तथा उदाहरण भी दीजिए।
उत्तर
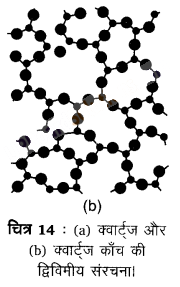
ठोसों का वर्गीकरण (Classification of Solids) – ठोसों को दो वृहत् प्रकारों- क्रिस्टलीय तथा अक्रिस्टलीय में वर्गीकृत किया जा सकता है। क्रिस्टलीय ठोसों में अवयवी कणों (परमाणु, आयन अथवा अणु) का क्रम सुव्यवस्थित होता है। क्रिस्टलीय ठोस साधारणत: लघु क्रिस्टलों की अत्यधिक संख्या से बना होता है, उनमें प्रत्येक का निश्चित अभिलक्षणिक जयामितीय आकार होता है। इसमें दीर्घ परासी व्यवस्था होती है अर्थात् कणों की व्यवस्था का पैटर्न नियमित होता है जिसकी सम्पूर्ण क्रिस्टल में एक से अन्तराल पर पुनरावृत्ति होती है। सोडियम क्लोराइड और क्वार्ट्ज क्रिस्टलीय ठोसों के विशिष्ट उदाहरण हैं।
अक्रिस्टलीय ठोस (ग्रीक अमोरफोस= आकृति नहीं होना) असमाकृति के कणों से बने होते हैं। इन ठोसों में अवयवी कणों (परमाणुओं, अणुओं अथवा आयनों) की व्यवस्था केवल लघु परासी व्यवस्था होती है। ऐसी व्यवस्था में नियमित और आवर्ती पुनरावृत्त पैटर्न केवल अल्प दूरियों तक देखा जाता है। ऐसे भाग बिखरे होते । हैं और इनके बीच व्यवस्था-क्रम अनियमित होते हैं। क्वार्ट्ज (क्रिस्टलीय) और क्वार्ट्ज काँच (अक्रिस्टलीय) की संरचनाएँ क्रमश: चित्र-14 (a) और (b) में दर्शाई गई हैं।
यद्यपि दोनों संरचनाएँ लगभग समरूप हैं, फिर भी अक्रिस्टलीय क्वार्ट्ज काँचे में दीर्घ परासी व्यवस्था नहीं है। अक्रिस्टलीय ठोसों की संरचना द्रवों के सदृश होती है। अवयवी कणों की व्यवस्था में अन्तर के कारण दोनों प्रकार के ठोसों के गुण भिन्न होते हैं।
अधिकतर ठोस पदार्थ (तत्त्व तथा यौगिक) क्रिस्टलीय प्रकृति के होते हैं। उदाहरण के लिए – सभी धात्विक तत्व; जैसे- लोहा, ताँबा और चाँदी; अधात्विक तत्व; जैसे-सल्फर, फॉस्फोरस और आयोडीन एवं यौगिक; जैसे सोडियम क्लोराइड, जिंक सल्फाइड और नैफ्थेलोन क्रिस्टलीय ठोस हैं। काँच, रबर और प्लास्टिक अक्रिस्टलीय ठोसों के विशिष्ट उदाहरण हैं। कुछ पदार्थ विभिन्न स्थितियों में भिन्न- भिन्न संरचनात्मक व्यवस्थाएँ प्राप्त करते हैं। ये व्यवस्थाएँ बहुरूप (polymorph) कहलाती हैं।

उदाहरणार्थ– डायमण्ड तथा ग्रेफाइट कार्बन के दो भिन्न बहुरूप हैं। इन भिन्न संरचनाओं के गुण; जैसे-गलनांक, घनत्व आदि भिन्न-भिन्न होते हैं। उदाहरणार्थ- ग्रेफाइट कोमल तथा विद्युत का अच्छा चालक होता है, जबकि डायमण्ड कठोर तथा विद्युत का दुर्बल चालक होता है। क्रिस्टलीय ठोसों को उनमें परिचालित अन्तराआण्विक बलों की प्रकृति के आधार पर चार वर्गों में वर्गीकृत किया जा सकता है। इनका वर्णन निम्नलिखित है –
(1) आण्विक ठोस (Molecular Solids)
आण्विक ठोसों के अवयवी कण अणु होते हैं। इन्हें निम्नलिखित उपवर्गों में वर्गीकृत किया जा सकता है –
(i) अधुवी आण्विक ठोस (Non-polar molecular solids) – इनके अन्तर्गत वे ठोस आते हैं जो या तो परमाणुओं उदाहरणार्थ– निम्न ताप पर ऑर्गन और हीलियम अथवा अध्रुवी सहसंयोजक बन्धों से बने अणुओं; उदाहरणार्थ– निम्न ताप पर H2, Cl2, और I2 द्वारा बने होते हैं। इन ठोसों में परमाणु अथवा अणु दुर्बल परिक्षेपण बलों अथवा लण्डन बलों द्वारा बँधे रहते हैं। ये ठोस मुलायम और विद्युत के अचालक होते हैं। इनके गलनांक निम्न कोटि के होते हैं और ये सामान्यत: कमरे के ताप और दाब पर द्रव अथवा गैसीय अवस्था में होते हैं।
(ii) ध्रुवीय-आण्विक ठोस (Polar molecular solids) – HCl, SO2 आदि पदार्थों के अणु ध्रुवीय सहसंयोजक बन्धों से बने होते हैं। ऐसे ठोसों में अणु अपेक्षाकृत प्रबल द्विध्रुव-द्विध्रुव अन्योन्यक्रियाओं (dipole-diple interactions) से एक-दूसरे के साथ बँधे रहते हैं। ये ठोस मुलायम और विद्युत के अचालक होते हैं। इनके गलनांक अध्रुवी आण्विक ठोसों से अधिक होते हैं, फिर भी इनमें से अधिकतर कमरे के ताप और दाब पर गैस अथवा द्रव हैं। ठोस SO2 और ठोस NH3 ऐसे ठोसों के उदाहरण हैं।
(iii) हाइड्रोजन आबन्धित आण्विक ठोस (Hydrogen bonded molecular solids) – ऐसे ठोसों के अणुओं में H और F, O अथवा N परमाणुओं के मध्य ध्रुवीय-सहसंयोजक बन्ध होते हैं। प्रबल हाइड्रोजन आबन्धन ऐसे ठोसों के अणुओं; जैसे-H2O (बर्फ) बंधित करते हैं। ये विद्युत के अचालक हैं। सामान्यतः ये कमरे के ताप और दाब पर वाष्पशील द्रव अथवा मुलायम ठोस होते हैं।
(2) आयनिक ठोस (Ionic Solids)
आयनिक ठोसों के अवयवी कण आयन होते हैं। ऐसे ठोसों का निर्माण धनायनों और ऋणायनों के त्रिविमीय विन्यासों में प्रबल कूलॉमी (स्थिर विद्युत) बलों से बँधने पर होता है। ये ठोस कठोर और भंगुर प्रकृति के होते हैं। इनके गलनांक और क्वथनांक उच्च होते हैं। चूंकि इनमें आयन गमन के लिए स्वतन्त्र नहीं होते; अतः ये ठोस अवस्था में विद्युतरोधी होते हैं। यद्यपि गलित अवस्था में अथवा जल में घोलने पर आयन गमन के लिए मुक्त हो जाते हैं और वे विद्युत का संचालन करते हैं।
(3) धात्विक ठोस (Metallic Solids)
धातुएँ मुक्त इलेक्ट्रॉनों के समुद्र से घिरे और उनसे जुड़े धनायनों के सुव्यवस्थित संग्रह हैं। ये इलेक्ट्रॉन गतिशील होते हैं और क्रिस्टल में सर्वत्र समरूप से विस्तारित होते हैं। प्रत्येक धात्विक परमाणु इन गतिशील इलेक्ट्रॉनों के समुद्र में एक अथवा अधिक इलेक्ट्रॉनों का योगदान देता है। ये मुक्त और गतिशील इलेक्ट्रॉन, धातुओं की उच्च विद्युत और ऊष्मीय चालकता के लिए उत्तरदायी होते हैं। विद्युत क्षेत्र प्रयुक्त करने पर ये इलेक्ट्रॉन धनायनों के नेटवर्क में सतत प्रवाह करते हैं। इसी प्रकार जब धातु के एक भाग में ऊष्मा संचरित की जाती है तो ऊष्मीय ऊर्जा मुक्त इलेक्ट्रॉनों द्वारा सर्वत्र एकसमान रूप से विस्तारित हो जाती है। धातुओं की दूसरी महत्त्वपूर्ण विशेषताएँ कुछ स्थितियों में उनकी चमक और रंग हैं। ये भी उनमें उपस्थित मुक्त इलेक्ट्रॉनों के कारण होती हैं। धातुएँ अत्यधिक आघातवर्धनीय और तन्य होती हैं।
(4) सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Network Solids)
अधात्विक क्रिस्टलीय ठोसों की विस्तृत बहुरूपता (polymorphism) सम्पूर्ण क्रिस्टल में निकटवर्ती परमाणुओं के मध्य सहसंयोजक बन्धों के बनने के कारण होती है। इन्हें विशाल अणु (giant molecule) भी कहा जाता है। सहसंयोजक बन्ध प्रबल और दिशात्मक प्रकृति के होते हैं; इसीलिए परमाणु अपनी स्थितियों पर अति प्रबलता से बँधे रहते हैं। ऐसे ठोस अत्यधिक कठोर और भंगुर होते हैं। इनका गलनांक अत्यन्त उच्च होता है और गलन से पूर्व ये विघटित भी हो सकते हैं। ये विद्युत का संचालन नहीं करते; अतः ये विद्युतरोधी होते हैं। हीरा और सिलिकन कार्बाइड ऐसे ठोसों के विशिष्ट उदाहरण हैं।
ग्रेफाइट मुलायम और विद्युत चालक है। इसके अपवादात्मक गुण इसकी विशिष्ट संरचना के कारण होते हैं। इसमें कार्बन परमाणु विभिन्न परतों में व्यवस्थित होते हैं और प्रत्येक परमाणु उसी परत के तीन निकटवर्ती परमाणुओं से सहसंयोजक बन्धन में होता है। प्रत्येक परमाणु का चौथा संयोजकता इलेक्ट्रॉन अलग परतों के मध्य उपस्थित होता है और यह गमन के लिए मुक्त होता है। यही मुक्त इलेक्ट्रॉन ग्रेफाइट को विद्युत का उत्तम चालक बनाते हैं। विभिन्न परतें एक-दूसरे पर फिसल सकती हैं। ये ग्रेफाइट को मुलायम ठोस और उत्तम ठोस-चिकनाई (Solid lubricant) बनाते हैं।
प्रश्न 2.
क्रिस्टल तन्त्र के प्रकारों की विस्तृत विवेचना कीजिए। उदाहरण भी दीजिए।
उत्तर
क्रिस्टल तन्त्र के प्रकार (Types of Crystal System) – सामान्यतया दो प्रकार की एकक कोष्ठिकाएँ मिलकर विभिन्न क्रिस्टल तन्त्र बनाती हैं। ये एकक कोष्ठिकाएँ निम्नलिखित हैं –
(1) आद्य एकक कोष्ठिकाएँ (Primitive unit cells) – जब अवयवी कण एकक कोष्ठिका के केवल कोनों पर उपस्थित हों तो उसे आद्य एकक कोष्ठिका कहा जाता है।
(2) केन्द्रित एकक कोष्ठिकाएँ (Centred unit cells) – जब एकक कोष्ठिका में एक अथवा अधिक अवयवी कण कोनों के अतिरिक्त अन्य स्थितियों पर भी उपस्थित होते हैं तो उसे केन्द्रित एकक कोष्ठिका कहते हैं। केन्द्रित एकक कोष्ठिकाएँ निम्नलिखित तीन प्रकार की होती हैं –
- अन्त:केन्द्रित एकक कोष्ठिका (Body-centred unit cells) – ऐसी एकक कोष्ठिका में एक अवयवी कण (परमाणु, अणु अथवा आयन) कोनों में उपस्थित कणों के अतिरिक्त उसके अन्त:केन्द्र में होता है।
- फलक-केन्द्रित एकक कोष्ठिका (Face-centred unit cells) – ऐसी एकक कोष्ठिका में कोनों पर उपस्थित अवयवी कणों के अतिरिक्त एक अवयवी कण प्रत्येक फलके के केन्द्र पर भी होता है।
- अंत्य-केन्द्रित एकक कोष्ठिका (End-centred unit cells) – ऐसी एकक कोष्ठिका में कोनों पर उपस्थित अवयवी कणों के अतिरिक्त एक अवयवी कण किन्हीं दो विपरीत फलकों के केन्द्र में पाया जाता है।
सात क्रिस्टल तन्त्र (Seven Crystal System) – जब क्रिस्टल जालक में एकक कोष्ठिका के जालक स्थल केवल कोनों पर स्थित होते हैं, तब यह सरल अथवा आद्य एकक कोष्ठिका कहलाती है। क्रिस्टलों के सभी प्रकारों में सात प्रकार की सरल अथवा आद्य एकक कोष्ठिकाएँ होती हैं। ये एकक कोष्ठिकाएँ लम्बाई a, b तथा c और कोण α, β तथा γ द्वारा अभिलक्षणित होती हैं। यह सात क्रिस्टल तन्त्र कहलाता है (चित्र-15)। सभी क्रिस्टलों को इनमें से किसी एक के द्वारा व्यक्त किया जा सकता है। ये सात प्रकार अग्रलिखित हैं –
(1) घनीय (Cubic) – इसमें तीनों अक्ष समान लम्बाई की एवं परस्पर समकोण पर होती हैं (a = b = c, सभी कोण = 90°)। इस प्रकार की एकक कोष्ठिका से बने क्रिस्टल घनीय क्रिस्टल कहलाते हैं। उदाहरणार्थ- NaCl, KCl, CaF2, ZnS, हीरा, CsSl आदि।
(2) चतुष्कोणीय या द्विसमलम्बाक्ष (Tetragonal or Dirhombic) – तीनों अक्ष परस्पर समकोण पर होती हैं, परन्तु केवल दो अक्ष समान लम्बाई की होती हैं (a = b ≠ c, सभी कोण = 90°)। इन क्रिस्टलों के उदाहरण SnO2, TiO2, Sn, यूरिया आदि हैं।
(3) विषमलम्बाक्ष (Orthorhombic) – इसमें तीन असमान अक्ष होती हैं जो परस्पर समकोण पर होती हैं (a ≠ b ≠ c, सभी कोण = 90°)। BaSO4, KNO3 आदि इस प्रकार के क्रिस्टलों के उदाहरण हैं।
(4) एकनताक्ष (Monoclinic) – इसमें असमान लम्बाई की तीन अक्ष होती हैं तथा दो कोण 90° के होते हैं (a ≠ b ≠ c, दो कोण = 90° तथा एक कोण ≠ 90°)। कैल्सियम सल्फेट (CaSO4.2H2O), पोटैशियम मैग्नीशियम सल्फेट [K2Mg(SO4)2.6H2O] आदि एकनताक्ष क्रिस्टलों के कुछ उदाहरण हैं।
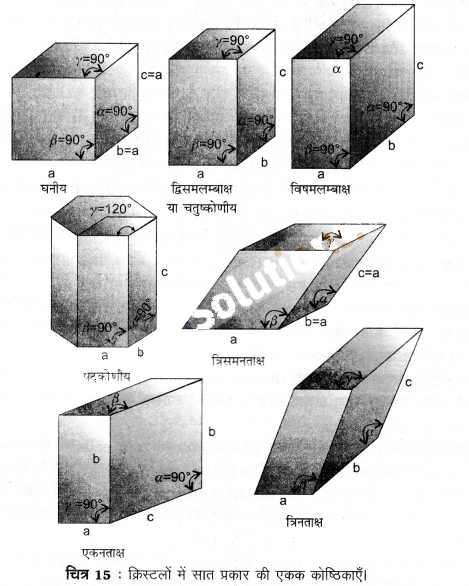
(5) त्रिसमनताक्ष अथवा त्रिकोणी (Rhombohedral or Trigonal) – इस प्रकार के क्रिस्टलों में तीनों अक्षों की भुजाएँ समान होती हैं। तीनों अन्तराअक्षीय (interfacial) कोण भी समान होते हैं; परन्तु कोणों का मान 90° नहीं होता है। उदाहरणार्थ- कैल्सियम कार्बोनेट (CaCO3), सोडियम नाइट्रेट (NaNO3), क्वार्ट्ज (SiO2), कैल्साइट आदि।
(6) त्रिनताक्ष (Triclinic) – इस प्रकार के क्रिस्टलों की संरचना में तीनों अक्षों की तीनों भुजाएँ। असमान होती हैं। तीनों कोण भी असमान होते हैं। कोई भी कोण 90° का नहीं होता है (a ≠ b ≠ c, α ≠ β ≠ γ ≠ 90°)। उदाहरण- कॉपर सल्फेट (CuSO4), पोटैशियम डाइक्रोमेट (K2Cr2O7), बोरिक अम्ल (H3BO3) आदि।
(7) षट्कोणीय (Hexagonal) – दो अक्षों की भुजाएँ (a तथा b) समान और तीसरे अक्ष की भुजा (c) इन दोनों से भिन्न होती है। दो अक्षीय कोण समान एवं 90° के तथा तीसरा कोण 120° का होता है। (d = b # c, दो कोण = 90° तथा एक कोण = 120°)। उदाहरण– कैल्सियम (Ca), जिंक (Zn), मैग्नीशियम (Mg), मर्करी सल्फाइड (HgS), बर्फ, ग्रेफाइट आदि।
प्रश्न 3.
निविड संकुलित संरचनाओं से आप क्या समझते हैं? एकविमा, द्विविमा तथा त्रिविमा में निविड संकुलन को समझाइए।
उत्तर
निविड संकुलित संरचनाएँ
(Close-packed Structures)
ठोसों में अवयवी कण निविड संकुलित होते हैं तथा उनके मध्य न्यूनतम रिक्त स्थान होता है। ये संरचनाएँ निविड संकुलित संरचनाएँ कहलाती हैं (यदि हम अवयवी कणों को समरूप कठोर गोले मानें जो एक-दूसरे के सम्पर्क में हैं)।
एकविमा में निविड संकुलन (Close Packing in One Dimension) जब कणों को प्रदर्शित करने वाले गोले एक पंक्ति में एक-दूसरे को स्पर्श करते हुए व्यवस्थित किए जाते हैं, तब यह एकविमा में निविड का संकुलन कहलाता है।

द्विविमा में निविड संकुलन (Close Packing in Two Dimension)
द्विविमीय निविड संकुलित संरचना निविड संकुलित गोलों की पंक्तियों को एकसाथ व्यवस्थित करके प्राप्त की जा सकती है। इसे निम्नलिखित दो भिन्न प्रकार से किया जा सकता है –
(1) प्रथम विधि के अन्तर्गत द्वितीय पंक्ति को प्रथम के सम्पर्क में इस प्रकार रखा जा सकता है कि द्वितीय पंक्ति के गोले प्रथम पंक्ति के गोलों के ठीक ऊपर हों तथा दोनों पंक्तियों के गोले क्षैतिजीय तथा साथ ही ऊध्र्वाधर रूप से संरेखित हों। यदि प्रथम पंक्ति को ‘A’ प्रकार की पंक्ति माना जाए तो द्वितीय पंक्ति प्रथम पंक्ति के ठीक समान होने के कारण, वह भी ‘A’ प्रकार की होगी। इसी प्रकार से अधिक पंक्तियों को रखकर AAA…. प्रकार की व्यवस्था प्राप्त की जा सकती है।
इसे चित्र-17 (a) में दिखाया गया है। स्पष्ट है कि इस व्यवस्था में प्रत्येक गोला चार निकटवर्ती गोलों के सम्पर्क में रहता है। इस प्रकार द्विविमीय उपसहसंयोजन संख्या चार है। साथ ही यदि इन सन्निकट चार गोलों के केन्द्रों को जोड़ा जाए तो एक वर्ग प्राप्त होता है। अतः इस संकुलन को द्विविमा में वर्ग निविड संकुलन (square close packing in two dimension) कहा जाता है।

(2) द्वितीय विधि के अन्तर्गत द्वितीय पंक्ति को प्रथम के ऊपर एकसमान रूप से इस प्रकार रखा जा सकता है कि उसके गोले प्रथम पंक्ति के अवनमनों में भली-भाँति व्यवस्थित हो जाएँ। यदि प्रथम पंक्ति के गोलों की व्यवस्था को ‘A’ प्रकार कहा जाए तो द्वितीय पंक्ति जो कि भिन्न है, उसे ‘B’ प्रकार कहा जा सकता है। जब तृतीय पंक्ति को द्वितीय के निकट एकसमान रूप से रखा जाता है तो उसके गोले प्रथम तल के गोलो से संरेखित होते हैं, अत: यह तल भी ‘A’ प्रकार का है। इसी प्रकार से रखे गए चौथी पंक्ति के गोले द्वितीय पंक्ति (‘B’ प्रकार) से संरेखित होते हैं, अत: यह व्यवस्था ABAB…. प्रकार की है।
इस व्यवस्था में मुक्त स्थान कम होता है और इसमें संकुलन, वर्ग निविड संकुलन से अधिक दक्ष है। प्रत्येक गोला छह निकटवर्ती गोलों के सम्पर्क में रहता है और द्विविमीय उपसहसंयोजन संख्या छह है। इन छह गोलों के केन्द्र सम-षट्कोण के कोनों पर हैं [चित्र-17 (b)]। इस प्रकार इस संकुलन को द्विविमा में षट्कोणीय निविड संकुलन कहा जाता है। चित्र-17 (b) में स्पष्ट परिलक्षित होता है कि इस तल में कुछ रिक्तियाँ हैं। जो त्रिकोणीय आकृति की हैं। इन्हें त्रिकोणीय रिक्तियाँ कहते हैं। ये दो प्रकार की होती हैं। एक पंक्ति में त्रिकोण का शीर्ष ऊर्ध्वमुखी और अगली पंक्ति में अधोमुखी होता है।
त्रिविमा में निविड संकुलन (Close Packing in Three Dimension)
सभी वास्तविक संरचनाएँ त्रिविम संरचनाएँ होती हैं। इन्हें द्विविमीय परतों को एक-दूसरे के ऊपर रखकर प्राप्त किया जा सकता है। वर्ग निविड संकुलित तथा षट्कोणीय निविड संकुलित संरचनाओं से त्रिविमीय संरचना निम्नवत् प्राप्त की जा सकती है –
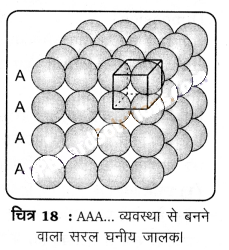
(1) द्विविम वर्ग निविड़ संकुलित परतों से त्रिविम निविड़ संकुलन (Three dimensional close packing from two dimensional square close packed layers) – इसके अन्तर्गत द्वितीय परत को प्रथम परत के ऊपर इस प्रकार रखा जाता है कि ऊपरी परत के गोले प्रथम परत के गोलों के ठीक ऊपर रहें। इस व्यवस्था में दोनों परतों के गोले पूर्णतया क्षैतिज तथा साथ ही ऊर्ध्वाधर रूप से सीध में होते हैं (चित्र-18), इसी प्रकार से हम और परतों को एक-दूसरे के ऊपर रख सकते हैं। यदि प्रथम परत के गोलों की व्यवस्था को ‘A’ प्रकार कहा जाए तो सभी परतों में समान व्यवस्था होती है। इस प्रकार इस जालक में AAA…. प्रकार का पैटर्न है। इस प्रकार उत्पन्न होने वाला जालक सरल घनीय जालक (simple cubic lattice) और उसकी एकक कोष्ठिका आद्य- घनीय एकक कोष्ठिका (primitive- cubic unit cell) है।
(2) द्विविम-षट्कोणीय निविड संकुलित परतों से त्रिविम निविड संकुलन (Three dimensional close packing from two dimensional-hexagonal close packed layers) – इसमें परतों को एक-दूसरे पर रखकर त्रिविमीय निविड संकुलित संरचना निम्नलिखित प्रकार से प्राप्त की जा सकती है –
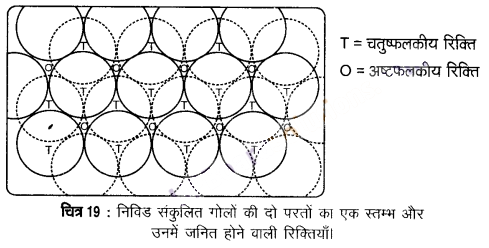
(i) द्वितीय परंत को प्रथम परत के ऊपर रखना (Placing the second layer on the first layer) – एक द्विविम-षट्कोणीय निविड संकुलित परत ‘A’ पर समान परत इस प्रकार रखते हैं कि द्वितीय परत के गोले प्रथम परत के अवनमनों में आ जाएँ। चूंकि दो परतों के गोले भिन्न प्रकार से संरेखित हैं, अतः द्वितीय परत को हम B परत कहते हैं। यह चित्र-19 में देखा जा सकता है कि प्रथम परत की सभी त्रिकोणीय रिक्तियाँ द्वितीय परत के गोलों से आवृत नहीं हैं। इससे अलग-अलग व्यवस्थाओं की उत्पत्ति होती है। जब भी द्वितीय परत का एक गोला प्रथम परत की रिक्ति के ऊपर होता है, तब एक चतुष्फलकीय रिक्ति बनती है। चित्र-19 में इन्हें ‘T’ से दर्शाया गया है।
अन्य स्थानों पर द्वितीय परत की त्रिकोणीय रिक्तियाँ प्रथम परत की त्रिकोणीय रिक्तियों के ऊपर हैं और इनकी त्रिकोणीय आकृतियाँ अतिव्यापित नहीं होती हैं। उनमें से एक में त्रिकोण का शीर्ष ऊर्ध्वमुखी और दूसरे में अधोमुखी होता है। इन रिक्तियों को चित्र-19 में ‘O’ से दर्शाया गया है। ये रिक्तियाँ छह गोलों से घिरी होती हैं तथा इन्हें अष्टफलकीय रिक्तियाँ कहा जाता है।
(ii) तृतीय परत को द्वितीय परत पर रखना (Placing the third layer on the second layer) – इस स्थिति में दो सम्भावनाएँ होती हैं –
(क) द्वितीय परत की चतुष्फलकीय रिक्तियों को तृतीय परत के गोलों द्वारा आच्छादित किया जा सकता है। इस स्थिति में तृतीय परत के गोले प्रथम परत के गोलों के साथ पूर्णत: संरेखित होते हैं। इस प्रकार गोलों का पैटर्न एकान्तर परतों में पुनरावृत्त होता है। इस पैटर्न को प्राय: ABAB… पैटर्न लिखा जाता है तथा इस संरचना को षट्कोणीय निविड संकुलित (hcp) संरचना कहते हैं। अनेक धातुओं; जैसे- मैग्नीशियम और जिंक में परमाणुओं की व्यवस्था hcp प्रकार की होती है।
(ख) तृतीय परत को द्वितीय परत पर इस प्रकार रखा जा सकता है कि गोले अष्टफलकीय रिक्तियों को आच्छादित करते हों। इस प्रकार से रखने पर तृतीय परत के गोले प्रथम अथवा द्वितीय किसी भी परत के साथ संरेखित नहीं होते। इस व्यवस्था को ‘C’ प्रकार कहा जाता है। केवल चौथी परत रखने पर उसके गोले प्रथम परत के गोलों के साथ संरेखित होते हैं। इस प्रकार के पैटर्न को प्राय: ABCABC…. लिखा जाता है। इस संरचना को घनीय निविड संकुलित संरचना (ccp) अथवा फलक-केन्द्रित घनीय (fcc) संरचना कहा जाता है। कुछ धातुएँ जैसे ताँबा तथा चाँदी इस संरचना में क्रिस्टलीकृत होते हैं।