UP Board Solutions for Class 12 Chemistry Chapter 6 General Principles and Processes of Isolation of Elements (तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम)
अभ्यास के अन्तर्गत दिए गए प्रश्नोत्तर
प्रश्न 1.
सारणी 6.1 (पाठ्यपुस्तक) में दर्शाए गए अयस्कों में से कौन-से चुम्बकीय पृथक्करण विधि द्वारा सान्द्रित किए जा सकते हैं?
उत्तर
वे अयस्क जिनमें कम-से-कम एक घटक (अशुद्धि या वास्तविक अयस्क) चुम्बकीय होता है, उन्हें चुम्बकीय पृथक्करण विधि द्वारा सान्द्रित किया जा सकता है; जैसे- हेमेटाइट (Fe2O3), मैग्नेटाइट (Fe3O4), सिडेराइट (FeCO3) तथा आयरन पाइराइट (FeS2) को चुम्बकीय पृथक्करण विधि द्वारा सान्द्रित किया जा सकता है।
प्रश्न 2.
ऐलुमिनियम के निष्कर्षण में निक्षालन का क्या महत्त्व है?
उत्तर
ऐलुमिनियम के निष्कर्षण में निक्षालन के उपयोग से बॉक्साइट अयस्क से अशुद्धियाँ जैसे SiO2, Fe2O3 आदि को हटाया जा सकता है तथा शुद्ध ऐलुमिना प्राप्त किया जा सकता है।
प्रश्न 3.
अभिक्रिया
Cr2O3 + 2 Al → Al2O3 + 2Cr (ΔfG– = – 421 kJ)
के गिब्ज ऊर्जा मान से लगता है कि अभिक्रिया ऊष्मागतिकी के अनुसार सम्भव है, पर यह कक्ष ताप पर सम्पन्न क्यों नहीं होती ?
उत्तर
ऊष्मागतिकीय रूप से सम्भव अभिक्रियाओं के लिए भी सक्रियण ऊर्जा की निश्चित मात्रा की आवश्यकता होती है, अतः दी गई अभिक्रिया को सम्पन्न करने के लिए अतिरिक्त ऊष्मा की आवश्यकता
होगी।
प्रश्न 4.
क्या यह सत्य है कि कुछ विशिष्ट परिस्थितियों में मैग्नीशियम, SiO2 को अपचयित कर सकता है और Si, MgO को? वे परिस्थितियाँ कौन-सी हैं?
उत्तर
1600 K (सिलिकन का गलनांक) से कम ताप पर, SiO2 के निर्माण के लिए Δf G– वक्र, MgO के Δf G– वक्र से ऊपर स्थित होता है; अत: 1600 K से कम ताप पर Mg, SiO2 को Si में अपचयित कर सकता है। दूसरी ओर 1600 K से अधिक ताप पर MgO के लिए Δf G– वक्र, SiO2 के Δf G– वक्र से ऊपर स्थित होता है; अत: 1600 K से अधिक ताप पर Si, MgO को Mg में अपचयित कर सकता है।
अतिरिक्त अभ्यास
प्रश्न 1.
कॉपर का निष्कर्षण हाइड्रोधातुकर्म द्वारा किया जाता है, परन्तु जिंक का नहीं। व्याख्या कीजिए।
उत्तर
![]()
से अधिक कियाशील होता है। कॉपर आयनों के विलयन से Cu2+ आयनों को Zn के द्वारा आसानी से प्रतिस्थापित किया जा सकता है।
Zn(s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
इस प्रकार, कॉपर को हाइड्रोधातुकर्म के द्वारा निष्कर्षित किया जा सकता है। परन्तु, जिंक को अधिक क्रियाशील होने के कारण, Zn2+ आयन युक्त विलयन से सरलता से विस्थापित नहीं किया जा सकता है। इस प्रकार, कॉपर को हाइड्रोधातुकर्म के द्वारा निष्कर्षित किया जा सकता है। परन्तु, जिंक को अधिक क्रियाशील होने के कारण, Zn2+ आयन युक्त विलयन से सरलता से विस्थापित नहीं किया जा सकता है। इसका कारण यह है कि जिंक से अधिक क्रियाशील धातु; जैसे-ऐलुमिनियम, मैग्नीशियम, कैल्सियम इत्यादि जल से क्रिया करती हैं इसलिए, जिंक को हाइड्रोधातुकर्म के द्वारा निष्कर्षित नहीं किया जा सकता है।
प्रश्न 2.
फेन प्लवन विधि में अवनमक की क्या भूमिका है?
उत्तर
फेन प्लवन विधि में अवनमक का मुख्य कार्य संकरता के द्वारा अयस्क के अवयवों में से किसी एक को फेन बनाने से रोकना है। जैसे, NaCN का प्रयोग अवनमक के रूप में PbS से ZnS अयस्क को पृथक् करने के लिए किया जाता है। यह ZnS के साथ संकर यौगिक बनाता है तथा इसको फेन बनाने से रोकता है।
![]()
इस प्रकार केवल PbS ही फेन बनाने के लिए उपलब्ध होता है तथा इसे ZnS से सरलता से पृथक् किया जा सकता है।
प्रश्न 3.
अपचयन द्वारा ऑक्साइड अयस्कों की अपेक्षा पाइराइट से ताँबे का निष्कर्षण अधिक कठिन क्यों है?
उत्तर
पायराइट अयस्क में, कॉपर Cu2S के रूप में विद्यमान रहता है। Cu2S के निर्माण की मानक मुक्त ऊर्जा (Δf G–), CS2 से अधिक होती है, जो कि एक ऊष्माशोषी यौगिक है। इसलिए, कार्बन या H2 का प्रयोग Cu2S को Cu धातु में अपचयित करने के लिए नहीं किया जा सकता है। इसके विपरीत Cu2O के Δf G– का मान CO, से बहुत कम होता है। इसलिए, Cu2O को कार्बन के द्वारा Cu धातु में सरलता से अपचयित किया जा सकता है।
Cu2O (s) + C (s) → 2Cu(s) + CO (g)
यही कारण है कि पायराइट से Cu का निष्कर्षण इसके ऑक्साइड के अपचयन द्वारा अधिक कठिन है।
प्रश्न 4.
व्याख्या कीजिए-
- मण्डल परिष्करण,
- स्तम्भ वर्णलेखिकी।
उत्तर
1. मण्डल परिष्करण (Zone refining) – यह विधि इस सिद्धान्त पर आधारित है कि अशुद्धियों की विलेयता धातु की ठोस अवस्था की अपेक्षा गलित अवस्था में अधिक होती है। अशुद्ध धातु की छड़ के एक किनारे पर एक वृत्ताकार गतिशील तापक लगा रहता है (चित्र-1)। इसकी सहायता से अशुद्ध धातु को गर्म किया जाता है। तापक जैसे ही आगे की ओर बढ़ता है, गलित से शुद्ध धातु क्रिस्टलित हो जाती है तथा अशुद्धियाँ संलग्न गलितं मण्डल में चली जाती हैं। इस क्रिया को कई बार दोहराया जाता है तथा तापक को एक ही दिशा में बार-बार चलाते हैं। अशुद्धियाँ छड़ के एक किनारे पर एकत्रित हो जाती हैं। इसे काटकर अलग कर लिया जाता है। यह विधि मुख्य रूप से अतिउच्च शुद्धता वाले अर्द्धचालकों जैसे जर्मेनियम, सिलिकन, बोरॉन, गैलियम एवं इण्डियम तथा अन्य अतिशुद्ध धातुओं को प्राप्त करने के लिए बहुत उपयोगी है।

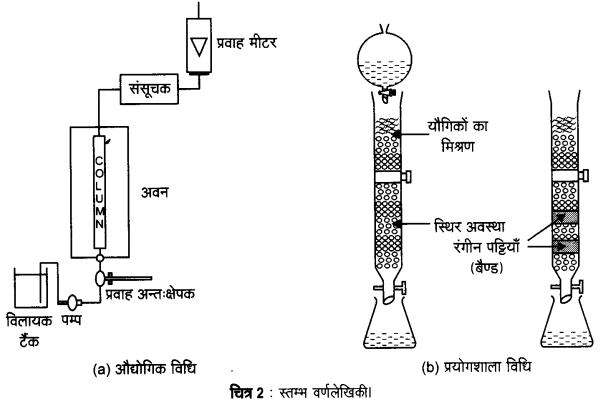
2. स्तम्भ वर्णलेखिकी (Column chromatography) – यह विधि इस सिद्धान्त पर आधारित है। कि अधिशोषक पर मिश्रण के विभिन्न घटकों का अधिशोषण अलग-अलग होता है। मिश्रण को द्रव या गैसीय माध्यम में रखा जाता है जो कि अधिशोषक में से गुजरता है। स्तम्भ में विभिन्न घटक भिन्न-भिन्न स्तरों पर अधिशोषित हो जाते हैं, बाद में अधिशोषित घटक उपयुक्त विलायकों (निक्षालक) द्वारा निक्षालित कर लिए जाते हैं। गतिशील माध्यम की भौतिक अवस्था, अधिशोषक पदार्थ की प्रकृति एवं गतिशील माध्यम के गमन के प्रक्रम पर निर्भर होने के कारण इसे ‘स्तम्भ वर्णलेखिकी‘ नाम दिया गया है। इस प्रकार की एक विधि में काँच की नली में Al2O3 का एक स्तम्भ बनाया जाता है तथा गतिशील माध्यम जिसमें अवयवों का विलयन उपस्थित होता है, द्रव प्रावस्था में होता है। यह स्तम्भ वर्णलेखिकी का एक उदाहरण है।
यह विधि सूक्ष्म मात्रा में पाए जाने वाले तत्वों के शुद्धिकरण और शुद्ध किए जाने वाले तत्व तथा अशुद्धियों के रासायनिक गुणों में अधिक भिन्नता न होने की स्थिति में शुद्धिकरण के लिए अत्यधिक उपयोगी होती है। स्तम्भ वर्णलेखिकी में प्रयुक्त प्रक्रम को चित्र-2 में दर्शाया गया है।
प्रश्न 5.
673 K ताप पर C तथा CO में से कौन-सा अच्छा अपचायक है?
उत्तर
673 K ताप पर C एवं CO में से CO एक अच्छा अपचायक है। इसको निम्न प्रकार समझाया जा सकता है –

एलिंघम चित्र (चित्र 3) में, C, CO2 वक्र लगभग क्षैतिज है, जबकि CO, CO2 वक्र उर्ध्वगामी हैं तथा दोनों वक्र 673 K पर एक-दूसरे को काटते हैं। C (s) + O2 (g) → CO2 (g) ऊर्जा की दृष्टि से कम सम्भाव्य है क्योंकि इसकी ΔfG– का मान अभिक्रिया 2CO (g) + O2 (g) → CO2 (g) की तुलना में कम ऋणात्मक होता है। इसलिए 673 K से नीचे CO एक अधिक अच्छे अपचायक के रूप में कार्य करता है।
प्रश्न 6.
कॉपर के विद्युत-अपघटन शोधन में ऐनोड पंक में उपस्थित सामान्य तत्वों के नाम दीजिए। वे वहाँ कैसे उपस्थित होते हैं?
उत्तर
कॉपर के वैद्युत शोधन में ऐनोड मड में उपस्थित सामान्य तत्त्व सेलेनिमय, टेलुरियम, सिल्वर, गोल्ड आदि हैं। ये तत्त्व कॉपर से कम क्रियाशील होते हैं तथा वैद्युत प्रक्रिया में अप्रभावित रहते हैं।
प्रश्न 7.
आयरन (लोहे) के निष्कर्षण के दौरान वात्या भट्टी के विभिन्न क्षेत्रों में होने वाली अभिक्रियाओं को लिखिए।
उत्तर
आयरन के ऑक्साइड अयस्कों को निस्तापन अथवा भर्जन से सान्द्रित करके, लाइमस्टोन तथा कोक के साथ मिश्रित करके वात्या भट्टी के हॉपर में डाला जाता है। वात्या भट्टी में विभिन्न ताप-परासों में आयरन ऑक्साइड का अपचयन होता है। वात्या भट्टी में होने वाली अभिक्रियाएँ निम्नलिखित हैं –
500 – 800 K पर (वात्या भट्टी में निम्न ताप परिसर में)
- 3Fe2O3 + CO → 2 Fe3O4 + CO2 ↑
- Fe3O4 + 4 CO → 3 Fe ↓ + 4CO2 ↑
- Fe2O3 + CO → 2 FeO + CO2 ↑
900 – 1500 K पर (वात्या भट्टी में उच्च ताप-परिसर में)
- C + CO2 → 2 CO ↑
- FeO + CO → Fe + CO2 ↑
चूना पत्थर (लाइमस्टोन) भी CaO में अपघटित हो जाता है जो अयस्क की सिलिकेट अशुद्धि को धातुमल के रूप में हटा देता है। धातुमल (slag) गलित अवस्था में होता है तथा आयरन से पृथक्कृत हो जाता है।
प्रश्न 8.
जिंक ब्लेण्ड से जिंक के निष्कर्षण में होने वाली रासायनिक अभिक्रियाओं को लिखिए।
उत्तर
जिंक ब्लेण्ड से जिंक के निष्कर्षण में होने वाली अभिक्रियाएँ निम्नलिखित हैं –
- सान्द्रण (Concentration) – अयस्क को पीसकर फेन प्लवन प्रक्रम द्वारा इसको सान्द्रण किया जाता है।
- भर्जन (Roasting) – सान्द्रित अयस्क का लगभग 1200 K ताप पर वायु की अधिकता में भर्जन किया जाता है जिससे जिंक ऑक्साईड (ZnO) प्राप्त होता है।

- अपचयन (Reduction) – प्राप्त जिंक ऑक्साइड को चूर्णित कोक के साथ मिलाकर एक फायर क्ले रिटॉर्ट में 1673 K तक गर्म किया जाता है, परिणामस्वरूप यह जिंक धातु में अपचयित हो जाता है।
ZnO + C Zn ↓ + CO ↑
1673 K पर जिंक धातु वाष्पीकृत होकर (क्वथनांक 1180 K) आसवित हो जाती है। - विद्युत-अपघटनी शोधन (Electrolytic refining) – अशुद्ध जिंक ऐनोड बनाता है तथा कैथोड शुद्ध जिंक की शीट से बना होता है। विद्युत-अपघट्य तनु H2SO4 से अम्लीकृत ZnSO4 विलयन होता है। विद्युत धारा प्रवाहित करने पर शुद्ध Zn कैथोड पर संगृहीत हो जाता है।
प्रश्न 9.
कॉपर के धातुकर्म में सिलिका की भूमिका समझाइए।
उत्तर
भर्जन के दौरान कॉपर पाइराइट FeO तथा Cu2O के मिश्रण में परिवर्तित हो जाता है।

FeO (क्षारीय) को हटाने के लिए प्रगलन के दौरान एक अम्लीय गालक सिलिका मिलाया जाता है। FeO, SiO2 से संयोग करके फेरस सिलिकेट (FeSiO3) धातुमल बनाता है जो गलित अवस्था में प्राप्त मैट पर तैरने लगता है।
![]()
अत: कॉपर के निष्कर्षण में सिलिका की भूमिका ऑक्साइड को धातुमल के रूप में हटाने की होती है।
प्रश्न 10.
‘वर्णलेखिकी पद का क्या अर्थ है?
उत्तर
वर्णलेखिकी (क्रोमैटोग्राफी) ग्रीक भाषा में क्रोमा का अर्थ रंग तथा ग्राफी का अर्थ लिखना होता है। शब्द का प्रयोग सर्वप्रथम 1906 में आईवेट (Iswett) के द्वारा पौधों से रंगीन पदार्थों को पृथक् करने के लिए किया गया था। अब इस शब्द का मूल अर्थ अस्तित्वहीन है क्योंकि आजकल इस तकनीक का प्रयोग व्यापक रूप में पृथक्करण, शोधन तथा रंगीन या रंगहीन मिश्रण के अवयवों के लक्षणीकरण (characterisation) तत्त्वों के निर्धारण में किया जाता है। यह कार्बनिक यौगिक के मिश्रण के अवयवों का दो प्रावस्थाओं के बीच वितरण के सिद्धान्त पर आधारित है। इन दोनों प्रावस्थाओं में एक स्थिर होती है, जो कि ठोस या द्रव हो सकती है। इसे स्थिर प्रावस्था कहते हैं। दूसरी प्रावस्था को गतिशील प्रावस्था कहते हैं। यह गतिशील प्रकृति की होती है और द्रव या गैस की बनी होती है।
प्रश्न 11.
वर्णलेखिकी में स्थिर प्रावस्था के चयन में क्या मापदण्ड अपनाए जाते हैं?
उत्तर
स्थिर प्रावस्था इस प्रकार के पदार्थ की बनी होनी चाहिए, जो कि अशुद्धियों को शुद्ध किये जाने वाले तत्त्व की अपेक्षा अधिक प्रबलता से अधिशोषित करने में सक्षम हो। इससे तत्त्व का निर्गमन (elution) सुगमता से हो जाता है।
प्रश्न 12.
निकिल-शोधन की विधि समझाइए।
उत्तर
निकिल-शोधन का मॉन्ड प्रक्रम (Mond process of nickel purification) – इस प्रक्रम में निकिल (अशुद्ध) को कार्बन मोनोक्साइड के प्रवाह में गर्म करने से वाष्पशील निकिल टेट्रोकार्बोनिल संकुल बन जाता है –

इस कार्बोनिल को और अधिक ताप पर गर्म करते हैं जिससे यह विघटित होकर शुद्ध धातु दे देता है।

प्रश्न 13.
सिलिका युक्त बॉक्साइट अयस्क में से सिलिका को ऐलुमिना से कैसे अलग करते हैं? यदि कोई समीकरण हो तो दीजिए।
उत्तर
शुद्ध ऐलुमिना को बॉक्साइट अयस्क से बायर प्रक्रम द्वारा पृथक्कृत किया जा सकता है। सिलिका युक्त बॉक्साईट अयस्क को NaOH के सान्द्र विलयन के साथ 473 – 523 K ताप पर तथा 35 – 36 bar दाब पर गर्म करते हैं। इससे ऐलुमिना, सोडियम ऐलुमिनेट के रूप में तथा सिलिका, सोडियम सिलिकेट के रूप में घुल जाता है तथा अशुद्धियाँ अवशेष के रूप में रह जाती हैं।

परिणामी विलयन को छानकर अविलेय अशुद्धियों (यदि कोई हो) को हटा दिया जाता है तथा इसे CO2 गैस प्रवाहित करके उदासीन कर दिया जाता है। इस अवस्था पर विलयन को ताजा बने हुए जलयोजित Al2O3 के नमूने से बीजारोपित किया जाता है जो अवक्षेपण को प्रेरित करता है।
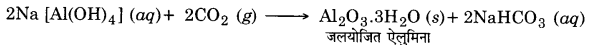
सोडियम सिलिकेट विलयन में शेष रह जाता है तथा जलयोजित ऐलुमिना को छानकर, सुखाकर तथा गर्म करके पुनः शुद्ध Al2O3 प्राप्त कर लिया जाता है।

प्रश्न 14.
उदाहरण देते हुए भर्जन व निस्तापन में अन्तर बताइए। (2009, 17)
उत्तर
निस्तापन में सान्द्रित अयस्क को उसके गलनांक से नीचे वायु की सीमित मात्रा में गर्म किया जाता है।

भर्जन में अयस्क को वायु की अधिकता में तीव्रता से गर्म करते हैं। इसके फलस्वरूप P, As, S आदि की अशुद्धियाँ ऑक्सीकृत हो जाती हैं तथा सल्फाइड अयस्क धातु ऑक्साइड में परिवर्तित हो जाता है।

प्रश्न 15.
ढलवाँ लोही कच्चे लोहे से किस प्रकार भिन्न होता है?
उत्तर
वात्या भट्टी से प्राप्त अशुद्ध आयरन को कच्चा लोहा कहा जाता है। इसमें S, P, Si, Mn आदि की अशुद्धियों के साथ लगभग 4% कार्बन होता है। ढलवां लोहे को बनाने के लिए कच्चे लोहे को गर्म वायु में स्क्रैप आयरन तथा कोक के साथ पिघलाया जाता है। इसमें कार्बन की मात्रा कम (लगभग 3%) पायी जाती है।
प्रश्न 16.
अयस्कों तथा खनिजों में अन्तर स्पष्ट कीजिए।
उत्तर
प्राकृतिक रूप से उपस्थित रासायनिक पदार्थ, जिनके रूप में धातुएँ अशुद्धियों के साथ भूपर्पटी में उपस्थित होती हैं, खनिज (minerals) कहलाते हैं। वे खनिज, जिनसे धातुओं का निष्कर्षण सरल तथा आर्थिक रूप से लाभदायक हो, अयस्क कहलाते हैं। अतः सभी अयस्क खनिज होते हैं, परन्तु सभी खनिज अयस्क नहीं होते हैं। उदाहरणार्थ– भूपर्पटी में लोहा ऑक्साइडों, कार्बोनेटों तथा सल्फाइडों के रूप में विद्यमान होता है। लोहे के इन खनिजों में से निष्कर्षण के लिए लोहे के ऑक्साइडों को चुना जाता है, इसलिए लोहे के ऑक्साइड, लोहे के अयस्क हैं। इसी प्रकार भूपर्पटी में ऐलुमिनियम दो खनिजों के रूप में पाया जाता है- बॉक्साइट (Al2O3 . xH2O) तथा क्ले (Al2O3 . 2SiO2 . 2H2O)। इन दोनों खनिजों में से बॉक्साइट से Al का निष्कर्षण सरलतापूर्वक तथा आर्थिक रूप से लाभदायक रूप में किया जा सकता है, इसलिए बॉक्साइट ऐलुमिनियम का अयस्क है।
प्रश्न 17.
कॉपर मैट को सिलिका की परत चढ़े हुए परिवर्तकों में क्यों रखा जाता है?
उत्तर
सिलिका युक्त परिवर्तक (बेसेमर परिवर्तक) में मैट में उपस्थित शेष FeS को FeO में ऑक्सीकृत करने के लिए रखा जाता है जो सिलिका के साथ संयोग कर संगलित धातुमल बनाता है।

जब सम्पूर्ण लोहे को धातुमल के रूप में पृथक् कर लिया जाता है, तब कुछ Cu2S ऑक्सीकरण के फलस्वरूप Cu2O बनाता है जो अधिक Cu2S के साथ अभिक्रिया करके कॉपर धातु बनाता है।
2Cu2S + 3O2 → 2Cu2O + 2SO2 ↑
2Cu2O + Cu2S → 6Cu ↓ + SO2 ↑
अत: कॉपर मैट को सिलिका की परत चढ़े हुए परिवर्तक में मैट में उपस्थित FeS को FeSiO3 धातुमल के रूप में हटाने के लिए भी रखा जाता है।
प्रश्न 18.
ऐलुमिनियम के धातुकर्म में क्रायोलाइट की क्या भूमिका है?
उत्तर
क्रायोलाइट, मिश्रण के संगलन ताप को कम करता है तथा ऐलुमिना की वैद्युत चालकता को बढ़ाता है जो कि वास्तव में विद्युत का अच्छा चालक नहीं होता है।
प्रश्न 19.
निम्न कोटि के कॉपर अयस्कों के लिए निक्षालन क्रिया को कैसे किया जाता है?
उत्तर
निम्न ग्रेड कॉपर अयस्क का निक्षालन वायु या जीवाणुओं की उपस्थिति में अम्ल के साथ क्रिया कर किया जाता है। इस प्रक्रिया में कॉपर Cu2+ आयनों के रूप में विलयन में चला जाता है।
Cu (s) + 2H+ (aq) + 1/2 O2 (g) → Cu2+ (aq) + H2O (l)
प्रश्न 20.
Co का उपयोग करते हुए अपचयन द्वारा जिंक ऑक्साइड से जिंक का निष्कर्षण क्यों नहीं किया जाता?
उत्तर
एलिंघम चित्र में CO, CO2 वक्र Zn, ZnO वक्र के ऊपर स्थित है। यह स्पष्ट करता है कि CO से CO2 बनाने के लिए Δf G– का मान Zn से ZnO के निर्माण के मान से कम ऋणात्मक है। इसलिए, यदि CO का अपचायक के रूप में प्रयोग किया जाता है, तो अपचयन में बहुत अधिक ताप की आवश्यकता होगी। यही कारण है कि जिंक को CO अपचायक के प्रयोग द्वारा ZnO से निष्कर्षित नहीं किया जाता है।
प्रश्न 21.
Cr2O3 के विरचन के लिए Δf G– का मान – 540 kJ mol-1 है तथा Al2O3 के लिए – 827 kJ mol-1 है। क्या Cr2O3 का अपचयन Al से सम्भव है?
उत्तर
हाँ, Al के द्वारा Cr2O3 का अपचयन सम्भव है। इसको निम्न प्रकार समझा जा सकता है –
इस प्रक्रिया में निहित अभिक्रियाएँ निम्न हैं –
2Al (s) + 3/2 O2 (g) → Al2O3 (s); Δf G– = – 827 kJ mol-1 …(i)
2Cr (s) + 3/2 O2 (g) → Cr2O3 (s) ; Δf G– = – 540 kJ mol-1 …(ii)
समीकरण (ii) में से (i) को घटाने पर
2Al (s) + Cr2O3 (3) → Al2O3 (s) + 2Cr (s);
Δf G– = – 827- (-540) = – 287 kJ mol-1
चूँकि संयुक्त रिडॉक्स अभिक्रिया के लिए Δf G– का मान ऋणात्मक है, इसलिए प्रक्रिया सम्भाव्य है। अर्थात् Al के द्वारा Cr2O3 का अपचयन सम्भव है।
प्रश्न 22.
C व CO में से ZnO के लिए कौन-सा अपचायक अच्छा है?
उत्तर
कार्बन CO से अधिक अच्छा अपचायक है, इसको अग्र प्रकार स्पष्ट किया जा सकता है –
एलिंघम चित्र में, C, CO वक्र Zn, ZnO वक्र से 1120 K से अधिक ताप पर नीचे स्थित तथा C, CO2 वक्र 1323 K से अधिक ताप पर नीचे स्थित है। इस प्रकार, C से CO के लिए Δf G– का मान तथा C, CO2 के लिए Δf G– के मान क्रमशः 1120 K तथा 1323 K पर C से ZnO के लिए Δf G– के मान से कम है जबकि CO, CO2 वक्र Zn, ZnO वक्र से 2273 K पर भी ऊपर है। इसलिए ZnO को C के द्वारा अपचयित किया जा सकता है परन्तु CO के द्वारा नहीं। इसलिए C व CO में से ZnO के अपचयन के लिए C अधिक अच्छा अपचायक है।
प्रश्न 23.
किसी विशेष स्थिति में अपचायक का चयन ऊष्मागतिकी कारकों पर आधारित है। आप इस कथन से कहाँ तक सहमत हैं? अपने मत के समर्थन में दो उदाहरण दीजिए।
उत्तर
किसी निश्चित धात्विक ऑक्साइड का धात्विक अवस्था में अपचयन करने के लिए उचित अपचायक का चयन करने में ऊष्मागतिकी कारक सहायता करता है। इसे निम्नवत् समझा जा सकता है –
एलिंघम आरेख से यह स्पष्ट होता है कि वे धातुएँ, जिनके लिए उनके ऑक्साइडों के निर्माण की मानक मुक्त ऊर्जा अधिक ऋणात्मक होती है, उन धातु ऑक्साइडों को अपचयित कर सकती हैं जिनके लिए उनके सम्बन्धित ऑक्साइडों के निर्माण की मानक मुक्त ऊर्जा कम ऋणात्मक होती है। दूसरे शब्दों में, कोई धातु किसी अन्य धातु के ऑक्साइड को केवल तब अपचयित कर सकती है, जबकि यह एलिंघम आरेख में इस धातु से नीचे स्थित हो। चूंकि संयुक्त रेडॉक्स अभिक्रिया का मानक मुक्त ऊर्जा परिवर्तन ऋणात्मक होगा (जो कि दोनों धातु ऑक्साइडों के Δf G– में अन्तर के तुल्य होता है।), अत: Al तथा Zn दोनों FeO को Fe में अपचयित कर सकते हैं, परन्तु Fe, Al2O3 को Al में तथा Zn0 को Zn में अपचयित नहीं कर सकता। इसी प्रकार C, ZnO को Zn में अपचयित कर सकता है, परन्तु CO ऐसा नहीं कर सकता।
प्रश्न 24.
उस विधि का नाम लिखिए जिसमें क्लोरीन सह-उत्पाद के रूप में प्राप्त होती है। क्या होगा यदि NaCl के जलीय विलयन का विद्युत-अपघटन किया जाए?
उत्तर
डाउन की प्रक्रिया में गलित NaCl के वैद्युत-अपघटन के फलस्वरूप सह-उत्पाद के रूप में क्लोरीन प्राप्त होती है।
NaCl (fused) → Na+ + Cl–
कैथोड पर : Na+ + e– → Na (s)
ऐनोड पर : Cl– + e– → 1/2 cl2 (g)
जब NaCl के जलीय विलयन का वैद्युत-अपघटन किया जाता है, तो कैथोड पर H2 गैस तथा ऐनोड पर Cl2 गैस प्राप्त होती हैं। NaOH का एक जलीय विलयन सह-उत्पाद के रूप में प्राप्त है।
NaCl (aq) → Na+ (aq) + Cl– (aq)
ऐनोड पर : Cl– (aq) + e– → 1/2 Cl2 (g)
कैथोड पर : 2H2O (l) + 2e– → 2OH (a) + H2 (g)
प्रश्न 25.
ऐलुमिनियम के विद्युत-धातुकर्म में ग्रेफाइट छड़ की क्या भूमिका है?
उत्तर
इस प्रक्रिया में ऐलुमिना, क्रायोलाईट तथा फ्लुओरस्पार (CaF2) के गलित मिश्रण का विद्युतअपघटन ग्रेफाइट को ऐनोड के रूप में तथा ग्रेफाइट की परत चढ़े हुए आयरन को कैथोड के रूप में प्रयुक्त करके किया जाता है। विद्युत-अपघटन करने पर Al कैथोड पर मुक्त होती है, जबकि ऐनोड पर CO तथा CO2 मुक्त होती हैं।
कैथोड पर : Al3+ (गलित) → Al (l)
ऐनोड पर : C (s) + O2- (गलित) → CO (g) + 2e–
C (s) + 2O2- (गलित) → CO2 (g) + 4e–
यदि किसी अन्य धातु को ग्रेफाइट के स्थान पर प्रयुक्त किया जाता है, तब मुक्त O2 न केवल इलेक्ट्रोड की धातु को ऑक्सीकृत ही करेगी, बल्कि कैथोड पर मुक्त Al की कुछ मात्रा को पुनः Al2O3 में परिवर्तित कर देगी। चूँकि ग्रेफाइट अन्य किसी धातु से सस्ता होता है, इसलिए इसे ऐनोड के रूप में प्रयुक्त किया जाता है। इस प्रकार ऐलुमिनियम के निष्कर्षण में ग्रेफाइट छड़ की भूमिका ऐनोड पर मुक्त O2 को संरक्षित करना है जिससे यह मुक्त होने वाले Al की कुछ मात्रा को पुन: Al2O3 में परिवर्तित न कर दे।
प्रश्न 26.
निम्नलिखित विधियों द्वारा धातुओं के शोधन के सिद्धान्तों की रूपरेखा दीजिए –
- मण्डल परिष्करण
- विद्युत-अपघटनी परिष्करण
- वाष्प प्रावस्था परिष्करण।
उत्तर
1. मण्डल परिष्करण (Zone refining) – इसके लिए अभ्यास-प्रश्न संख्या 4(i) देखिए।
2. विद्युत-अपघटनी परिष्करण (Electrolytic Refining) – इस विधि में अशुद्ध धातु को ऐनोड बनाते हैं। उसी धातु की शुद्ध धातु-पट्टी को कैथोड के रूप में प्रयुक्त करते हैं। इन्हें एक उपयुक्त विद्युत-अपघट्य का विलयन विश्लेषित्र में रखते हैं जिसमें उसी धातु का लवण घुला रहता है। अधिक क्षारकीय धातु विलयन में रहती है तथा कम क्षारकीय धातुएँ ऐनोड पंक (anode mud) में चली जाती हैं। इस प्रक्रम की व्याख्या, विद्युत विभव की धारणा, अधिविभव तथा गिब्ज ऊर्जा के द्वारा (उपयोग) भी की जा सकती है। ये अभिक्रियाएँ निम्नलिखित हैं –
ऐनोड पर : M → Mn+ + ne–
कैथोड पर : Mn+ + ne– → M
उदाहरण– ताँबे का शोधन विद्युत-अपघटनी विधि के द्वारा किया जाता है। अशुद्ध कॉपर ऐनोड के रूप में तथा शुद्ध कॉपर पत्री कैथोड के रूप में लेते हैं। कॉपर सल्फेट का अम्लीय विलयन विद्युत-अपघट्य होता है तथा विद्युत अपघटन के वास्तविक परिणामस्वरूप शुद्ध कॉपर ऐनोड से कैथोड की तरफ स्थानान्तरित हो जाता है।
ऐनोड पर : Cu → Cu2+ + 2e–
कैथोड पर : Cu2+ + 2e– → Cu
फफोलेदार कॉपर से अशुद्धियाँ ऐनोड पंक के रूप में जमा होती हैं जिसमें एण्टिमनी, सेलीनियम टेल्यूरियम, चाँदी, सोना तथा प्लैटिनम मुख्य होती हैं। इन तत्वों की पुन: प्राप्ति से शोधन की लागत की क्षतिपूर्ति हो सकती है। जिंक को शोधन भी इसी प्रकार से किया जा सकता है।
3. वाष्प प्रावस्था परिष्करण (Vapour Phase Refining) – इस विधि में धातु को वाष्पशील यौगिक में परिवर्तित करके दूसरे स्थल पर एकत्र कर लेते हैं। इसके बाद इसे विघटित करके शुद्ध धातु प्राप्त कर लेते हैं। इस प्रक्रिया की दो आवश्यकताएँ होती हैं –
- उपलब्ध अभिकर्मक के साथ धातु वाष्पशील यौगिक बनाती हो तथा
- वाष्पशील पदार्थ आसानी से विघटित हो सकता हो जिससे धातु आसानी से पुनः प्राप्त की जा सके।
उदाहरण– जिर्कोनियम या टाइटेनियम के शोधन के लिए वॉन-आरकैल विधि : यह Zr तथा Ti जैसी कुछ धातुओं से अशुद्धियों की तरह उपस्थित सम्पूर्ण ऑक्सीजन तथा नाईट्रोजन को हटाने में बहुत उपयोगी है। परिष्कृत धातु को निर्वातित पात्र में आयोडीन के साथ गर्म करते हैं। धातु आयोडाइड अधिक सहसंयोजी होने के कारण वाष्पीकृत हो जाता है।
Zr + 2I2 → ZrI4
धातु आयोडाइड को विद्युत धारा द्वारा 1800 K ताप पर गर्म किए गए टंग्स्टन तन्तु पर विघटित किया जाता है। इस प्रकार से शुद्ध धातु तन्तु पर जमा हो जाती है।
ZrI4 → Zr ↓ + 2I2 ↑
प्रश्न 27.
उन परिस्थितियों का अनुमान लगाइए जिनमें Al, MgO को अपचयित कर सकता है।
उत्तर
दोनों अभिक्रियाएँ इस प्रकार हैं –
Al + O2 → Al2O3 ; Δf G– Al, Al2O3 …(i)
2Mg + O2 → 2MgO ; Δf G– Mg, MgO
एलिंघम आरेख द्वारा स्पष्टीकरण – कुछ ऑक्साइडों के विरचन में AG° तथा T के एलिंघम आरेख निम्नवत् हैं –

उपर्युक्त आरेख से स्पष्ट है कि 1665 K से नीचे तापमान पर Al2O3 का Δf G– मान MgO की तुलना में कम ऋणात्मक है। अतः जब समीकरण
- को समीकरण
- में से घटाया जाता है तो संयुक्त रेडॉक्स अभिक्रियाओं अर्थात् समीकरण
- का Δf G– ऋणात्मक होता है।
2Mg + Al2O3 → 2MgO + Al ; Δf G– = – ve …(iii)
इस प्रकार 1665 K से नीचे तापमान पर Mg, Al2O3 को Al में अपचयित कर सकता है। 1665 K से अधिक तापमान पर Al2O3 का Δf G– मान MgO की तुलना में अधिक ऋणात्मक होता है। इसलिए जब समीकरण (ii) को समीकरण (i) में से घटाया जाता है तो संयुक्त रेडॉक्स अभिक्रिया अर्थात् समीकरण (iv) का Δf G– ऋणात्मक होता है।
Al+ 2 MgO → Al2O3 + 2Mg ; Δf G– = – Ve …(iv)
अत: 1665 K से अधिक तापमान पर Al, MgO को Mg में अपचयित कर सकता है।
परीक्षोपयोगी प्रश्नोत्तर
बहुविकल्पीय प्रश्न
प्रश्न 1.
निम्नलिखित में से कौन-सा अयस्क नहीं है? (2017)
(i) आयरन पाइराइट
(ii) हॉर्न सिल्वर
(iii) मैलेकाइट
(iv) पिग आयरन
उत्तर
(iv) पिग आयरन
प्रश्न 2.
कौन से अयस्क का सान्द्रण फेल प्लवन विधि द्वारा किया जाता है? (2017)
(i) कार्बोनेट
(ii) सल्फाइड
(iii) ऑक्साइड
(iv) फॉस्फेट
उत्तर
(ii) सल्फाइड
प्रश्न 3.
लौह अयस्कों का सान्द्रण किया जाता है – (2010, 17)
(i) गुरुत्व पृथक्करण विधि द्वारा।
(ii) फेन प्लवन विधि द्वारा
(iii) चुम्बकीय पृथक्करण विधि द्वारा
(iv) अमलगम विधि द्वारा।
उत्तर
(iii) चुम्बकीय पृथक्करण विधि द्वारा
प्रश्न 4.
निम्नलिखित में से कौन क्षारीय गालक नहीं है?
(i) CaCO3
(ii) CaO
(iii) SiO2
(iv) MgO
उत्तर
(iii) SiO2
प्रश्न 5.
वात्या भट्टी में आयरन ऑक्साइड अपचयित होता है – (2009, 18)
(i) SiO2 द्वारा
(ii) C द्वारा
(iii) CO द्वारा
(iv) CaCO3 द्वारा
उत्तर
(iii) CO द्वारा
अतिलघु उत्तरीय प्रश्न
प्रश्न 1.
अयस्क किसे कहते हैं? अयस्क तथा खनिज में क्या अन्तर है? (2009, 12)
उत्तर
खनिज-पृथ्वी में धातु तथा उनके यौगिक जिस रूप में मिलते हैं, वे खनिज कहलाते हैं; जैसे- रॉक साल्ट (rock salt), NaCl आदि।
अयस्क- वे खनिज जिनसे किसी शुद्ध धातु का निष्कर्षण अधिक मात्रा में सुविधापूर्वक व कम व्यय पर किया जा सके, उस धातु के अयस्क कहलाते हैं; जैसे- लोहे का अयस्क हेमेटाइट, Fe2O3 : 2H2O है। अतः सभी अयस्क खनिज होते हैं, परन्तु सभी खनिज अयस्क नहीं होते हैं।
प्रश्न 2.
ऐलुमिनियम के दो प्रमुख अयस्कों के नाम तथा सूत्र लिखिए। (2012)
उत्तर
ऐलुमिनियम के दो प्रमुख अयस्क इस प्रकार हैं –
- बॉक्साइट Al2O3 : 2H2O
- क्रायोलाइट Na3AIF6
प्रश्न 3.
ऐलुनाइट अयस्क का संगठन लिखिए। (2012)
उत्तर
K2SO4 : Al2(SO4)3 : 4 Al(OH)3
प्रश्न 4.
कॉपर के दो प्रमुख अयस्कों के नाम तथा सूत्र लिखिए। (2016, 12, 15, 16, 17)
उत्तर
कॉपर के दो प्रमुख अयस्क क्यूप्राइट (Cu2O) व कॉपर पायराइट (CuFeS2) हैं।
प्रश्न 5.
किन्हीं दो सल्फाइड अयस्कों के नाम लिखिए। (2012)
उत्तर
- अर्जेण्टाइट (Ag2S)
- कैल्कोपायराइट (CuFeS2)
प्रश्न 6.
डायस्पोर तथा केरार्जिराइट किन धातुओं के अयस्क हैं? (2009)
उत्तर
- डायस्पोर- ऐलुमिनियम;
- केरार्जिराइट- सिल्वर
प्रश्न 7.
लोहे के प्रमुख अयस्कों के नाम तथा सूत्र लिखिए। (2009, 10, 11, 13, 17)
उत्तर
1, ऑक्साइड अयस्क – लाल हेमेटाइट (Fe2O3 . 2H2O), मैग्नेटाइट (Fe3O4)
2. जलीय ऑक्साइड अयस्क – भूरा हेमेटाइट या लिमोनाइट (Fe2O3 : 3H2O)
3. कार्बोनेट अयस्क – सिडेराइट (FeCO3)
4. सल्फाइड अयस्क – आयरन पाइराइट (FeS2), कॉपर आयरन पाइराइट या कैल्को पाइराइट (CuFeS2)
प्रश्न 8.
ऐजुराइट तथा सिडेराइट अयस्कों का सूत्र लिखिए। (2012)
उत्तर
ऐजुराइट- 2CuCO3 . Cu(OH)2, सिडेराइट (FeCO3)
प्रश्न 9.
आधात्री की व्याख्या कीजिए। (2009)
उत्तर
खनिजों में मिट्टी, कंकड़, पत्थर आदि अनावश्यक पदार्थ अशुद्धियों के रूप में मिले रहते हैं। इन पदार्थों को गैंग या आधात्री कहते हैं।
प्रश्न 10.
फेन प्लवन विधि द्वारा किन अयस्कों का सान्द्रण किया जाता है। इस विधि का वर्णन | कीजिए। (2009, 11, 17)
उत्तर
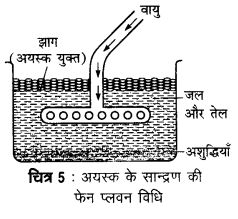
यह विधि अयस्क तथा आधात्री (gangue) की किसी द्रव से भीगने की प्रवृत्ति पर निर्भर करती है। इस विधि में बारीक पिसे हुए अयस्क को जल तथा तेल के मिश्रण में डालकर वायु प्रवाहित की जाती है। अशुद्ध अयस्क तेल के साथ झाग (फेन) बनाकर ऊपर तैरने लगता है और अपद्रव्य नीचे बैठ जाते हैं। इस विधि में चीड़ का तेल (pine oil) या क्रीओसेट तेल (creosate oil) काम में लाया जाता है। सल्फाइड अयस्कों का सान्द्रण इसी विधि से किया जाता है।
प्रश्न11.
अयस्कों का सान्द्रण क्यों आवश्यक है? चुम्बकीय पृथक्करण विधि से क्या तात्पर्य है? (2012)
उत्तर
खानों से प्राप्त अयस्कों में मिट्टी, कंकड़, पत्थर आदि मिले होते हैं जिन्हें आधात्री कहते हैं। आधात्री के कारण शुद्ध धातु प्राप्त करने में अवरोध उत्पन्न होता है तथा धन व समय का भी अपव्यय होता है। अत: धातु निष्कर्षण के पूर्व अयस्क से इन अशुद्धियों को दूर किया जाता है जिसे अयस्क का सान्द्रण कहते हैं।

चुम्बकीय पृथक्करण – सान्द्रण की यह विधि पदार्थों के चुम्बकीय तथा अचुम्बकीय गुणों पर निर्भर करती है। किसी अयस्क में उपस्थित चुम्बकीय अशुद्धि को इस विधि के द्वारा पृथक् कर सकते हैं। टिन-स्टोन (SnO2) में कुछ चुम्बकीय पदार्थ; जैसे- Fe3O4 आदि मिला होता है। अयस्क के महीन चूर्ण को दो बेलनों पर लगी पट्टी (belt) पर डालते हैं। इनमें से एक बेलन चुम्बकीय होता है। पट्टी को चलाने पर चुम्बकीय तथा अचुम्बकीय पदार्थ अलग-अलग स्थानों पर एकत्रित होते जाते हैं, जैसा कि चित्र में प्रदर्शित किया गया है। इस विधि में महीन चूर्ण को पट्टी पर डालते रहते हैं तथा पट्टी बेलनों की सहायता से चलती रहती है। विद्युत चुम्बकीय ध्रुवों के प्रभावों के कारण चुम्बकीय पदार्थ उससे दूर पृथक्-पृथक् होते जाते हैं। इस प्रकार से सान्द्रित अयस्क एकत्रित कर लिया जाता है।
प्रश्न 12.
गालक किसे कहते हैं? उदाहरण सहित समझाइए। (2011, 12, 13, 15, 16, 17)
उत्तर
गालक– गालक उस पदार्थ को कहते हैं जो अयस्क में उपस्थित अगलनीय अशुद्धियों के साथ उच्च ताप पर क्रिया करके इनको आसानी से गलाकर पृथक् होने वाले पदार्थों के रूप में दूर कर देते हैं। अशुद्धियों की गालक से क्रिया के फलस्वरूप बने गलनीय पदार्थ को धातुमल कहा जाता है। धातुमल, धातु से हल्का होने के कारण उसके ऊपर एक अलग पर्त के रूप में तैरने लगता है जिसको अलग कर लेते हैं। गालक दो प्रकार के होते हैं –
1. अम्लीय गालक; जैसे- SiO2। यह क्षारीय अशुद्धियों; जैसे- CaO, FeO आदि को दूर करता है।
2. क्षारीय गालक; जैसे- चूने का पत्थर (CaCO3)। यह अम्लीय अशुद्धियों; जैसे- SiO2, P2O5 को दूर करता है।
प्रश्न 13.
अम्लीय गालक क्या है? धातुकर्म में इसकी क्या उपयोगिता है? एक उदाहरण देकर समझाइए।
उत्तर
वे गालक जो क्षारीय अशुद्धियों से क्रिया करके धातुमल बनाते हैं, अम्लीय गालक कहलाते हैं। सिलिका (SiO2) तथा बोरेक्स प्रमुख अम्लीय गालक हैं।
![]()
प्रश्न 14.
SiO2 अशुद्धि दूर करने के लिए उपयुक्त गालक लिखिए तथा सम्बन्धित अभिक्रिया लिखिए। (2009)
उत्तर
SiO2 अशुद्धि दूर करने के लिए उसमें क्षारीय गालक CaCO3 लिया जाता है।

प्रश्न15.
धातुमल किसे कहते हैं? एक उदाहरण से समझाइए। (2009, 12, 13, 15, 16)
उत्तर
अयस्क में कुछ अशुद्धियाँ ऐसी होती हैं जिनका गलनांक बहुत अधिक होता है। गालक इन अशुद्धियों से मिलकर द्रवित पदार्थ बनाते हैं जिसे धातुमल कहते हैं। यह धातु से हल्का होने के कारण ऊपर तैरता रहता है जिसे निथारकर अलग कर दिया जाता है।
अशुद्धि + गालक = धातुमल
उदाहरणार्थ- FeO में SiO2 मिलाने पर FeSiO3 धातुमल प्राप्त होता है।
![]()
प्रश्न 16.
निस्तापन किसे कहते हैं? उदाहरण देकर समझाइए। (2009, 11, 16)
उत्तर
वह क्रिया जिसमें अयस्क को इतना गर्म करते हैं कि वह पिघले नहीं तथा अयस्क से गैसीय पदार्थ या वाष्पशील पदार्थ पृथक् हो जाते हैं, निस्तापन कहलाती है। गैस निकलने पर अयस्क सरन्ध्र (porous) हो जाता है; जैसे- कार्बोनेट अयस्क गर्म होकर ऑक्साइड अयस्क तथा CO2 में बदल जाता है।
ZnCO3 → ZnO + CO2 ↑
प्रश्न 17.
भर्जन किसे कहते हैं? उदाहरण देकर समझाइए। (2011, 16, 17)
उत्तर
वह क्रिया जिसमें अयस्क को वायु की उपस्थिति में उसके गलनांक से नीचे गर्म किया जाता है, भर्जन कहलाती है। इस क्रिया में S, As आदि वाष्पशील अशुद्धियाँ ऑक्साइडों के रूप में पृथक् हो जाती हैं। और सल्फाइड अयस्क ऑक्साइड में बदल जाता है।
S + O2 → SO2 ↑
4 As + 3O2 → 2 As2O3 ↑
2 Zns + 3O2 → 2 ZnO + 2 SO2 ↑
प्रश्न 18.
जिंक ब्लैण्ड से जिंक के निष्कर्षण में भर्जन व अपचयन की अभिक्रिया का रासायनिक समीकरण दीजिए। (2014)
उत्तर
जिंक ब्लैण्ड (ZnS) एक सल्फाइड अयस्क है, अत: इसका निष्कर्षण फेन प्लवन विधि द्वारा सान्द्रित करने के पश्चात् निम्न पदों में किया जाता है –
1. जिंक ब्लैण्ड अयस्क का भर्जन – सान्द्रित जिंक ब्लैण्ड को परावर्तनी भट्ठी में 927°C पर वायु की उपस्थिति में गर्म करने पर यह (ZnS) अपने ऑक्साइड (ZnO) में परिवर्तित हो जाता है। अभिक्रिया निम्न है।
2 ZnS + 3O2 → 2 ZnO + 2 SO2 ↑
Zns + 2O2 → ZnSO4
2 ZnSO4 2 ZnO + 2 SO2 ↑ + O2 ↑
2. ऑक्साइड का अपचयन – भर्जन क्रिया से प्राप्त ZnO को कार्बन के साथ गर्म करने पर ZnO का Zn में अपचयन हो जाता है।
ZnO + C Zn + CO ↑
प्रश्न 19.
प्रगलन क्या है? उदाहरण देकर स्पष्ट कीजिए। (2009, 10, 12, 13, 14, 15, 16, 17, 18)
या
प्रगलन में किस भट्टी का प्रयोग करते हैं ? इसका नामांकित चित्र बनाइए। (2009, 15)
उत्तर
अयस्क में उचित गालक मिलाकर मिश्रण को उच्च ताप पर गलाने की क्रिया को प्रगलन कहते हैं। इस क्रिया में अयस्क का गलित धातु में अपचयन हो जाता है अथवा धातुयुक्त पदार्थ पिघल जाता है। गालक अयस्क में उपस्थित अपद्रव्य से क्रिया करके धातुमल बनाता है जिसे अलग कर लेते हैं। इसमें वात्या भट्ठी का प्रयोग करते हैं।

लोहा तथा ताँबा धातुओं के निष्कर्षण में वात्या भट्ठी का उपयोग होता है।
उदाहरणार्थ– कॉपर पाइराइट से कॉपर का निष्कर्षण वात्या भट्ठी में प्रगलन द्वारा किया जाता है। इसमें निम्नलिखित अभिक्रियाएँ होती हैं –
Cu2O + Fes → Cu2S + FeO
2 Fes + 3O2 → 2 FeO + 2 SO2 ↑
FeO + SiO2 → FeSiO3
प्रश्न 20.
प्रगलन में कोक और गालक का प्रयोग क्यों किया जाता है? व्याख्या कीजिए। (2009, 17)
उत्तर
प्रगलन में कोक तथा गालक के प्रयोग से अयस्क के निस्तापन से प्राप्त ऑक्साइड को कोक अपचयित करता है, जिससे गलित धातु प्राप्त हो जाती है और अपद्रव्य गालक से क्रिया करके धातुमल के रूप में अलग हो जाते हैं। इससे अयस्क का गलनांक भी कम हो जाता है।
प्रश्न 21.
ऐलुमिनो-थर्मिक विधि क्या है ? इसके उपयोग लिखिए। (2012)
उत्तर
धातुओं के ऑक्साइडों को ऐलुमिनियम चूर्ण के साथ उच्च ताप पर गर्म करने से धातुएँ प्राप्त होती हैं। यह क्रिया ऊष्माक्षेपी है तथा इसको एलुमिनोथर्मिक विधि कहते हैं।
3 Co3O4 + 8 Al → 9 Co + 4Al2O5
3 Mn3O4 + 8 Al → 9 Mn + 4 Al2O5
इस विधि का उपयोग CO, Mn और Cr धातुओं के निष्कर्षण और थर्माइट वेल्डिंग में किया जाता है।
प्रश्न 22.
लीचिंग क्या है? एक उदाहरण द्वारा समझाइए। (2015)
उत्तर
यह विधि रासायनिक परिवर्तन पर आधारित है। इसके अन्तर्गत बारीक पिसे अयस्क को उचित अभिकर्मक के साथ क्रिया कराते हैं। जिससे विलयन की अवस्था में परिवर्तन आ जाता है तथा अशुद्धियाँ ठोस अवस्था में रह जाती हैं।
उदाहरण– बॉक्साइट अयस्क को सान्द्रण करने के लिए Al2O5 . 2H2O की क्रिया NaOH से कराने पर NaAlO2 बन जाता है जो जल में विलेय है और अशुद्धियाँ; जैसे- सिलिका, Fe2O3 नीचे ठोस के रूप में अवक्षिप्त हो जाती हैं।
Al2O3 . 2H2O + 2 NaOH → 2 NaAlO2 + 3 H2O
NaAlO2 + 2H2O → Al(OH)3 + NaOH
प्रश्न23.
लोहे के निष्कर्षण के दौरान वात्या भट्टी में चूने का पत्थर क्यों डालते हैं? समझाइए। (2015)
उत्तर
लोहे के निष्कर्षण के दौरान वात्या भट्टी में मिलाया गया चूना पत्थर (CaCO3) गालक का कार्य करता है। यह धातुमल (SiO2) से संयोग करके धातुमल (CaSiO3) कैल्सियम सिलिकेट बनाता है।
प्रश्न 24.
इस्पात का ऊष्मा उपचार क्यों आवश्यक है ? यह किस प्रकार किया जाता है? (2010, 11, 12)
उत्तर
इस्पात के यान्त्रिक गुण उसके ऊष्मा उपचार पर निर्भर करते हैं। ऊष्मा उपचार द्वारा इस्पात को कठोर या नर्म बनाया जा सकता है।
इस्पात का कठोरीकरण – इस्पात को रक्त-तप्त ताप तक गर्म करके ठण्डे जल द्वारा उसे एकाएक ठण्डा करने की क्रिया इस्पात का कठोरीकरण (hardening of steel) कहलाती है। इस क्रिया से इस्पात बहुत कठोर और भंगुर हो जाता है।
इस्पात का टैम्परीकरण – कठोरीकृत (hardened) इस्पात को किसी उच्च ताप तक (पहले से कम ताप पर) पुनः गर्म करके धीरे-धीरे ठण्डा करने की क्रिया इस्पात का टैम्परीकरण (tempering) कहलाती है। इस क्रिया से इस्पात नर्म (soft) हो जाता है और उसकी भंगुरता (brittleness) मिट जाती है। इस्पात को धीरे-धीरे ठण्डा करने पर ऑस्टीनाइट धीरे-धीरे सीमेन्टाइट और आइरन में अपघटित हो जाता है, जिससे इस्पात नर्म हो जाता है।
प्रश्न 25.
ढलवाँ लोहा, पिटवाँ लोहा तथा इस्पात में अन्तर लिखिए।
उत्तर
- ढलवाँ लोहा – इसमें लगभग 93 से 94% Fe, 2 से 4% C तथा शेष Si, P तथा Mn की अशुद्धियाँ होती हैं।
- पिटवाँ लोहा – इसमें 98.8% से 99.9% Fe और 0.1 से 0.25% C तथा शेष Si, P और Mn की अशुद्धियाँ होती हैं।
- इस्पात – इसमें 98 से 99.8% Fe और 0.25 से 1.5% C होता है।
प्रश्न 26.
स्टेनलेस स्टील का संगठन तथा उपयोग लिखिए।
उत्तर
Fe – 74%, Ni – 8%, Cr (18%)
उपयोग– बर्तन, मूर्तियाँ, बॉल बेयरिंग तथा शल्य चिकित्सा के औजार बनाने में।
प्रश्न 27.
फेरिक क्लोराइड के दो रासायनिक गुण लिखिए।
उत्तर
1. जल- अपघटन पर यह HCl उत्पन्न करता है; अत: इसका जलीय विलयन अम्लीय प्रकृति का होता है।
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
2. पोटैशियम फेरोसायनाइड विलयन के साथ यह नीले रंग का फेरिक फेरोसायनाइड (प्रशियन ब्लू) बनाता है।

प्रश्न 28.
कॉपर के किसी एक मिश्र-धातु का संघटन तथा उपयोग लिखिए। (2011)
उत्तर
- पीतल– Cu (80%), Zn (20%)
- उपयोग– इसका उपयोग बर्तन बनाने में किया जाता है।
प्रश्न 29.
जिंक ऑक्साइड के दो उपयोग लिखिए। (2011)
उत्तर
- सफेद वर्णक (pigment) के रूप में तथा
- क्रीम, पाउडर और टूथपेस्ट बनाने में।
प्रश्न 30.
क्रायोलाइट का सूत्र लिखिए। इसका उपयोग किस धातुकर्म में होता है?
उत्तर
क्रायोलाइट का सूत्र Na3AlF6 है। यह ऐलुमिनियम के धातुकर्म में प्रयुक्त होता है।
प्रश्न 31.
फ्लुओरस्पार का सूत्र लिखिए। इसका ऐलुमिनियम के निष्कर्षण में क्या उपयोग है? (2009, 12, 17)
उत्तर
फ्लुओरस्पार का सूत्र CaF2 है। ऐलुमिनियम के निष्कर्षण में इसका उपयोग तरलता बढ़ाने के लिए किया जाता है।
प्रश्न 32.
ऐलुमिना के वैद्युत-अपघटन में क्रायोलाइट का उपयोग समझाइए। (2009, 12)
उत्तर
क्रायोलाइट ऐलुमिना का गलनांक कम करता है तथा ऐलुमिना के वेद्युत-अपघटन में सहायता करता है क्योंकि शुद्ध ऐलुमिना विद्युत कुचालक है परन्तु क्रायोलाइट की सहायता से यह वैद्युत सुचालक हो जाता है।
प्रश्न 33.
Al(OH)3 उभयधर्मी है, समझाइए। (2011)
उत्तर
Al(OH)3 उभयधर्मी है क्योंकि यह अम्लों व अपने से प्रबल क्षारों के साथ क्रिया करके लवण व जल बनाता है।

प्रश्न 34.
अमलगम तथा मिश्रधातु में क्या अन्तर है?
उत्तर
दो या दो से अधिक धातुओं या धातु व अधातु के समांग मिश्रण को धातु संकर या मिश्रधातु कहते हैं। ये प्राय: ठोस होती हैं। यदि मिश्रधातु में एक धातु मर्करी हो तो इसे अमलगम कहते हैं। ये प्राय: द्रव होती हैं।
लघु उत्तरीय प्रश्न
प्रश्न 1.
परावर्तनी भट्टी का नामांकित चित्र दीजिए और संक्षेप में इसकी कार्य-विधि का वर्णन कीजिए। (2009, 11, 12, 13, 17)
या
परावर्तनी भट्टी का नामांकित चित्र बनाइए। (2018)
उत्तर
भर्जन क्रिया परावर्तनी भट्ठी में करायी जाती है। इस भट्ठी में ईंधन अलग स्थान पर जलाया जाता है। तथा गर्म किये जाने वाले अयस्क को सीधे ज्वाला के सम्पर्क में नहीं आने देते हैं। यह केवल गर्म गैसों के सम्पर्क में आकर गर्म होता है। इस प्रक्रम में गर्म किये जाने वाला पदार्थ भट्टी तल (hearth) पर रखा जाता है और ईंधन अग्नि स्थान (fire place) में जलाया जाता है। इसका उपयोग ऑक्सीकरण तथा अपचयन दोनों प्रकार के प्रक्रमों में करते हैं। इस भट्टी का प्रयोग ताँबा, लेड, टिन आदि धातुओं के धातुकर्म में किया जाता है।

प्रश्न 2.
मफल भट्टी का सरल नामांकित चित्र बनाइए तथा इसका संक्षिप्त विवरण दीजिए। इसका उपयोग किस धातु के निष्कर्षण में किया जाता है? (2010, 12)
उत्तर
मफल भट्ठी के अन्दर, दो उच्च ताप सह (refractory) ईंटों से बने हुए कोष्ठ होते हैं जिनको मफल (muffle) कहते हैं जैसा कि संलग्न चित्र में दिखाया गया है। सान्द्रित अयस्क को इन मफलों (रिटार्टी) के अन्दर बन्द कर दिया जाता है। दोनों मफलों को विद्युत द्वारा या ईंधन जलाकर चारों तरफ से गर्म किया जाता है। इस प्रकार इस भट्टी में न तो ईंधन और न ही ज्वाला गर्म होने वाले पदार्थ के सम्पर्क में आ सकते हैं। इस भट्ठी में पदार्थ को अत्यधिक ताप तक गर्म किया जा सकता है। धातु पिघलने पर दोनों बगलों में बने हुए निकास द्वारों के द्वारा बाहर निकल जाती है।
जिन धातुओं को गर्म करने पर ईंधन तथा उसके जलने से उत्पन्न गैसों के सम्पर्क में लाना ठीक नहीं होता उन्हीं का निष्कर्षण मफल भट्ठी में करते हैं। इसका उपयोग चाँदी, सोना, जिंक व लेड के धातुकर्म में किया जाता है।

प्रश्न 3.
इस्पात के निर्माण में प्रयुक्त होने वाली खुले तल की भट्टी का नामांकित चित्र बनाइए। (2009)
या
सीमेन्स-मार्टिन की खुली भट्टी का नामांकित चित्र बनाइए। (2009, 11, 13)
उत्तर

प्रश्न 4.
बेसेमर परिवर्तक द्वारा ढलवाँ लोहे से इस्पात कैसे प्राप्त किया जाता है? बेसेमर परिवर्तक का चित्र दीजिए और उसमें होने वाली रासायनिक अभिक्रिया का समीकरण भी दीजिए। (2010, 11)
उत्तर
इस विधि में ढलवाँ लोहे को एक बेसेमर परिवर्तक में भरकर उसमें वायु या ऑक्सीजन और भाप का मिश्रण प्रवाहित किया जाता है।
बेसेमर प्रक्रम– यह प्रक्रम बेसेमर परिवर्तक (Bessemer’s Converter) में किया जाता है जिसे संलग्न चित्र में दर्शाया गया है।
यह परिवर्तक पिटवाँ लोहे या इस्पात का अण्डाकार आकृति का पात्र होता है जिसमें उच्च ताप सह (refractory) सिलिको यो डोलोमाइट ईंटों का अस्तर लगा होता है। वायु-प्रवाह हेतु इसमें नीचे की ओर छिद्र होते हैं। इस पात्र को एक क्षैतिज अक्ष पर चारों ओर घुमाया जा सकता है। परिवर्तक में वात्या भट्ठी से प्राप्त पिघला हुआ ढलवाँ लोहा भरकर नीचे से वायु प्रवाहित की जाती है। जिसके फलस्वरूप सिलिकॉन तथा मैंगनीज के ऑक्साइड प्राप्त होते हैं।
Si + O2 → SiO2
2Mn + O2 → 2 MnO
ये ऑक्साइड परस्पर अभिक्रिया करके मैंगनीज सिलिकेट धातुमल बनाते हैं जिसे पृथक् कर दिया जाता है।
MnO + SiO2 → MnSiO3 ↓ (धातुमल)
सल्फर, ऑक्सीकृत होकर SO2 बनाती है, जो ऊपर निकल जाती है। कार्बन, कार्बन मोनोक्साइड में परिणित हो जाती है जो कि परिवर्तक के मुंह पर नीली लौ से जलती है। इस ज्वाला से CO गैस की उपस्थिति का आभास मिलता है। CO गैस जलना बन्द होने का तात्पर्य है कि अभिक्रिया पूर्ण हो गयी है। तत्पश्चात् इसमें स्पीगेल (spiegel) की आवश्यक मात्रा मिलाते हैं (स्पीगेल में लोहे के साथ मैंगनीज तथा कार्बन भी उपस्थित होता है) जिससे लोहे में कार्बन की आवश्यक मात्रा हो जाती है तथा इस्पात प्राप्त होता है।

प्रश्न 5.
हूप विधि द्वारा ऐलुमिनियम धातु के शोधन का वर्णन कीजिए।
उत्तर
ऐलुमिना के वैद्युत-अपघटन से प्राप्त ऐलुमिनियम धातु में अनेक अशुद्धियाँ होती हैं, जिनको हूप विधि (Hoopes process) से शुद्ध किया जाता है। यह एक वैद्युत-अपघटनी विधि है। ऐनोड के रूप में कार्य करने वाले कार्बन अस्तर लगे एक लोहे के पात्र में सबसे नीचे ताँबा तथा सिलिकन युक्त अशुद्ध ऐलुमिनियम की मिश्रित धातु लगी होती है, जो चालक को कार्य करती है। इसके ऊपर अशुद्ध ऐलुमिनियम धातु का गलित रखा जाता है। इसके ऊपर Na, Ba तथा Al के फ्लुओराइडों के मिश्रण तथा Al2O3 का गलित रखा जाता है, जो वैद्युत-अपघट्य का कार्य करता है। सबसे ऊपर पिघले हुए शुद्ध ऐलुमिनियम की एक पर्त होती है, जो कैथोड का कार्य करती है, जिसमें चालक का कार्य करने हेतु एक ग्रेफाइट की छड़ लगी होती है।
वैद्युत धारा प्रवाहित करने पर अशुद्ध ऐलुमिनियम से शुद्ध ऐलुमिनियम ऊपर की सतह पर आ जाता है और इतनी ही मात्रा में अशुद्ध ऐलुमिनियम को पात्र में लगे कीप से डाल दिया जाता है। इस प्रकार शुद्ध ऐलुमिनियम नीचे की पर्त (ऐनोड) से ऊपर की पर्त (कैथोड) पर आ जाता है और अशुद्धियाँ नीचे बैठ जाती हैं। शुद्ध ऐलुमिनियम को ऊपरी पर्त में बने छिद्र से अलग करके चादरों, छड़ों आदि के रूप में बदल दिया जाता है।

प्रश्न 6.
सिलिका युक्त बॉक्साइट का शोधन किस प्रकार किया जाता है ? रासायनिक समीकरण भी दीजिए। (2009, 11, 16)
या
सपॅक की विधि द्वारा ऐलुमिना को शोधन कैसे करेंगे? (2016)
उत्तर
जब बॉक्साइट में SiO2 की अशुद्धि अधिकता में होती है, तब सपेंक की विधि का प्रयोग किया जाता है। इस विधि में बॉक्साइट में कार्बन का चूर्ण मिलाकर मिश्रण को 1800°C तक गर्म करके इसमें नाइट्रोजन प्रवाहित की जाती है जिससे ऐलुमिनियम नाइट्राइड (AIN) बनता है तथा सिलिका अपचयित होकर वाष्पशील सिलिकॉन में परिवर्तित हो जाती है।

इस प्रकार प्राप्त ऐलुमिनियम नाइट्राइड को पानी के साथ गर्म करने पर इसका जल-अपघटन हो जाता है। जिससे ऐलुमिनियम हाइड्रॉक्साइड का अवक्षेप प्राप्त होता है। इस अवक्षेप को जल से धोकर सुखाकर तेज गर्म करने पर निर्जल ऐलुमिना प्राप्त होता है।

प्रश्न 7.
जब बॉक्साइट अयस्क में फेरिक ऑक्साइड की अशुद्धि अधिक होती है तथा जब सिलिका की अशुद्धि अधिक होती है तो बॉक्साइट से ऐलुमिना प्राप्त करने की विधि का मान तथा रासायनिक समीकरण लिखिए। (2016)
उत्तर
बॉक्साइट अयस्क में फेरिक ऑक्साइड भी अशुद्धि अधिक होने पर इससे एलुमिना प्राप्त करने के लिए बेयर विधि का प्रयोग किया जाता है।

बॉक्साइट अयस्क में सिलिका की अशुद्धि अधिक होने पर इससे ऐलुमिना प्राप्त करने के लिए सपेंक विधि का प्रयोग किया जाता है।

दीर्घ उत्तरीय प्रश्न
प्रश्न 1.
ढलवाँ लोहे का उसके अयस्क से निष्कर्षण की विधि का वर्णन कीजिए। इस निष्कर्षण में प्रयुक्त होने वाली भट्टी के प्रमुख क्षेत्रों में होने वाली अभिक्रियाओं को लिखिए। (2009, 12)
या
लोहे का उदाहरण देते हुए प्रगलन की प्रक्रिया की भट्टी का चित्र एवं रासायनिक समीकरण द्वारा समझाइए। (2018)
उत्तर
ढलवाँ लोहे का निष्कर्षण वात्या भट्टी द्वारा किया जाता है। यह निष्कर्षण हेमेटाइट अयस्क से निम्नलिखित पदों में किया जाता है –
1. धावन– लोहे के अयस्कों में 20 – 55% के बीच लोहा होता है इसीलिए इसका सान्द्रण करने की आवश्यकता नहीं पड़ती है। हल्की अशुद्धियाँ; जैसे- रेत, मिट्टी आदि घनत्व पृथक्करण विधि द्वारा पृथक् कर ली जाती हैं। अयस्क के महीन चूर्ण पर जल की धारा प्रवाहित करने से अशुद्धियाँ जल के साथ बह जाती हैं तथा लोहे का भारी अयस्क नीचे बैठ जाता है।
2. चुम्बकीय सान्द्रण – इस विधि में मैग्नेटाइट अयस्क का सान्द्रण चुम्बकीय विधि द्वारा किया जाता है।
3. प्रारम्भिक भर्जन अथवा निस्तापन – अयस्क को बारीक टुकड़ों में करके, उसमें कोयला मिलाया जाता है, फिर इस मिश्रण को कम गहरी भट्ठियों में तथा वायु की अधिकता में गर्म किया जाता है। इस प्रकार निस्तापने करने से निम्नलिखित परिवर्तन होते हैं –
- नमी भाप बनकर निकल जाती है
- अयस्क में उपस्थित कार्बनिक पदार्थ CO2 के रूप में निकल जाते हैं।
- गन्धक तथा आर्सेनिक क्रमशः SO2 व As2O3 के रूप में निकल जाते हैं।
- कार्बोनेट अयस्क अपघटित होकर फेरस ऑक्साइड बनाता है, जो फेरिक ऑक्साइड में ऑक्सीकृत हो जाता है, जिससे गलनीय फेरस सिलिकेट (FeSiO3) नहीं बनता है।
FeCO3 → FeO + CO2 ↑
4 FeO + O2 → 2Fe2O3 - अयस्क सरन्ध्र (porous) हो जाता है जिससे इसका अपचयन सरलतापूर्वक हो जाता है।
4. प्रगलन – निस्तापित अयस्क में कोक तथा चूने का पत्थर मिलाकर उसे कप तथा कोन व्यवस्था की सहायता से धीरे-धीरे एक बड़ी वात्या भट्ठी में प्रगलित किया जाता है। नीचे से शुष्क तथा गर्म वायु ईंधन को गर्म करने के लिए प्रवाहित की जाती है। भट्टी से निकलने वाली गर्म गैसों को एक धूल कक्ष तथा काउपर स्टोव में से प्रवाहित किया जाता है। इस व्यवस्था से काफी ईंधन बच जाता है। जैसे-जैसे चार्ज नीचे खिसकता है, वह अधिक ताप के कटिबन्धों (zones) में से गुजरता है। नीचे पहुँचकर लोहा पिघल जाता है। इसके ऊपर धातुमल की परत तैरने लगती है। धातुमल को ऊपर के छेद से तथा पिघली धातु को नीचे के छेद से निकाल लेते हैं। पिघली धातु को साँचों में ढाल लेते हैं। इस प्रकार ढलवाँ लोहा प्राप्त होता है।
[संकेत– वात्या भट्टी के लिए पृष्ठ 165 पर चित्र देखें]
वात्या भट्ठी में होने वाली अभिक्रियाएँ – विभिन्न कटिबन्धों में निम्नलिखित अभिक्रियाएँ होती हैं –
(i) प्रारम्भिक ताप का कटिबन्ध – यह भट्ठी का सबसे ऊपर का क्षेत्र है। यहाँ ताप 250°C रहता है। यहाँ चार्ज की सारी नमी दूर हो जाती है।
(ii) अपचयन का ऊपरी कटिबन्ध – यहाँ ताप लगभग 300°C – 900°C रहता है। यहाँ नीचे से आने वाली गर्म वायु, कोक से क्रिया करके CO बनाती है।
2C + O2 → 2 CO ↑
यह गैस नीचे से ऊपर उठती है और लोहे के ऑक्साइडों को स्पंजी लोहे में अपचयित कर देती है।
- 3Fe2O3 + CO 2 Fe3O4 + CO2 ↑
- Fe3O4 + CO 3 FeO + CO2 ↑
- FeO + CO Fe + CO2 ↑
700°C पर चूने का पत्थर भी अपघटित हो जाता है।
- CaCO3 CaO + CO2 ↑
- CaCO3 + C → CaO + 2CÓ ↑
अतः ऊपर उठने वाली गैसे CO तथा CO2 का मिश्रण होती हैं।
(iii) अपचयन का निचला कटिबन्ध – यहाँ ताप 900°C – 1200°C रहता है। इस कटिबन्ध में स्पंजी लोहे की उपस्थिति में CO की नियोजन क्रिया (2 CO → CO2 + C) उत्प्रेरित होकर कार्बन देती है। यह कार्बन निचले कटिबन्ध के लोहे से संयोग करता है। कार्बन के साथ Mn, P, S, Si आदि अशुद्धियाँ भी लोहे से संयोग कर लेती हैं। इस कारण लोहा 1200°C पर ही पिघल जाता है,
जबकि इसका गलनांक 1580°C है।
(iv) गलन कटिबन्ध – यहाँ ताप 1200°C – 1500°C रहता है। इसमें स्पंजी लोहा पूर्णतया पिघल । जाता है। इसमें C, Mn, P, Si आदि अशुद्धियाँ घुल जाती हैं तथा चूना, सिलिका व ऐलुमिना के साथ धातुमल बनाती हैं जो पिघले लोहे पर तैरने लगता है।

धातुमल के कारण लोहा वायु की ऑक्सीजन के सम्पर्क में आकर ऑक्सीकृत नहीं होने पाता।
प्रश्न 2.
सल्फाइड अयस्क से धातु (कॉपर) निष्कर्षण की विधि का वर्णन कीजिए। सम्बन्धित रासायनिक समीकरण भी दीजिए। (2009, 10, 11, 12, 13, 14, 15, 16, 17)
या
कॉपर पायराइट से ताँबे के निष्कर्षण की विधि का वर्णन कीजिए। सम्बन्धित रासायनिक समीकरण लिखिए। प्राप्त धातु को किस प्रकार शुद्ध करेंगे? (2009, 10, 11, 12, 13, 14, 15, 16, 17)
उत्तर
कॉपर को मुख्य अयस्क कॉपर पायराइट (CuFeS2) है जो कि सल्फाइड अयस्क है। कॉपर पायराइट से ताँबा निष्कर्षित करने के लिए निम्नलिखित प्रक्रम करने होते हैं –
1. सान्द्रण – अयस्क को बारीक पीसकर चूर्ण बना लिया जाता है तत्पश्चात् फेन प्लवन विधि (Froth Floatation Process) द्वारा सान्द्रण कर लेते हैं।
2. भर्जन – सान्द्रित अयस्क को हवा की अधिकता और न्यून ताप पर गर्म किया जाता है जिसे भर्जन कहा जाता है। यह क्रिया परावर्तनी भट्ठी (Reverberatory furnace) में होती है। इस भट्ठी में गैस की ज्वालाएँ अयस्क पर प्रतिबिम्बित होती हैं। भट्ठी में हवा के लिए विशेष छेद बने होते हैं। भर्जन क्रिया में अयस्क में निम्नलिखित परिवर्तन होते हैं –
- अयस्क में उपस्थित मुक्त सल्फर SO2 में ऑक्सीकृत होकर बाहर निकल जाता है।
S + O2 → SO2 - आर्सेनियस की अशुद्धि वाष्पशील (volatile) आर्सेनियस ऑक्साइड के रूप में बाहर निकल जाती है।
4As + 3O2 → 2As2O3 ↑ - कॉपर पायराइट, क्यूप्रस सल्फाइड और फेरस सल्फाइड में बदल जाता है।
2CuFeS2 + O2 → Cu2S + 2 Fes + SO2 ↑ - अधिकांश फेरस सल्फाइड, फेरस ऑक्साइड में बदल जाता है।
2Fes + 3O2 → 2FeO + 2SO2 ↑ - क्यूप्रस सल्फाइड आंशिक रूप से क्यूप्रस ऑक्साइड में बदल जाती है।
2 Cu2S + 3O2 → 2Cu2O + 2SO2 ↑
भर्जन के बाद कॉपर व आयरन के ऑक्साइड और सल्फाइड का मिश्रण प्राप्त होता है, जिसे भर्जित अयस्क कहते हैं।
3. प्रगलन – भर्जित अयस्क में सिलिका और कोक मिलाकर मिश्रण को वाया भट्ठी में प्रगलित किया जाता है। यह भट्ठी स्टील की प्लेटों की बनी होती है जिसके अन्दर अग्निसह ईंटों का अस्तर तथा बाहर वॉटर जैकेट लगा होता है। भट्ठी के निचले भाग में ट्वीयर (tuyers) लगे होते हैं जिनसे गर्म वायु का झोंका भट्ठी में भेजा जाता है। गलित पदार्थ भट्ठी के तल में एकत्रित होते हैं तथा अवशिष्ट गैसें भट्ठी के ऊपरी भाग से बाहर निकलती हैं। प्रगलन में निम्नलिखित परिवर्तन होते हैं –
- क्यूप्रस ऑक्साइड फेरस सल्फाइड से क्रिया करके क्यूप्रस सल्फाईड में बदल जाता है।
Cu2O + FeS → Cu2S + FeO - फेरस सल्फाइड की काफी मात्रा फेरस ऑक्साइड में परिवर्तित हो जाती है।
2Fes + 3O2 → 2FeO + 2SO2 ↑ - फेरस ऑक्साइड सिलिका (SiO2) से संयोग करके गलित फेरस सिलिकेट बनाता है जिसे धातुमल (slag) कहते हैं। सिलिको गालक का कार्य करता है।
FeO + SiO2 → FeSiO3 ↓
क्यूप्रस सल्फाइड और फेरस सल्फाइड का गलित मिश्रण जिसे मैट (matte) कहते हैं, भट्ठी के पेंदे में एकत्रित हो जाता है और मैट के ऊपर गलित धातुमल की परत जमा हो जाती है। मैट को निकास द्वार से बाहर निकाल दिया जाता है। इसमें लगभग 50% ताँबा होता है।
4. बेसेमरीकरण – गलित मैट में थोड़ी सिलिका मिलाकर एक बेसेमर परिवर्तक में भर देते हैं और उसमें गर्म वायु का झोंका प्रवाहित किया जाता है। बेसेमर परिवर्तक में नाशपाती की आकृति का स्टील का पात्र होता है जिसके भीतर अग्निसह ईंटों तथा लाइम का अस्तर लगा रहता है। इसकी बगल में, काफी ऊँचाई पर ट्वीयर लगा होता है जिसके द्वारा गर्म वायु का झोंका परिवर्तक में भेजा जाता है। गलित मैट और सिलिका के मिश्रण में गर्म वायु का झोंका प्रवाहित करने पर निम्नलिखित अभिक्रियाएँ होती हैं –
- मैट में उपस्थित फेरस सल्फाइड फेरस ऑक्साइड में बदल जाता है।
2FeS + 3O2 → 2FeO + 2SO2 ↑ - फेरस ऑक्साइड सिलिका से संयोग करके गलित फेरस सिलिकेट (धातुमल) बनाता है।
FeO + SiO2 → FeSiO3 ↓ - क्यूप्रस सल्फाइड का कुछ भाग क्यूप्रस ऑक्साइड में परिवर्तित हो जाता है जो बचे हुए क्यूप्रस सल्फाइड से क्रिया करके कॉपर बनाता है।
2 Cu2S + 3O2 → 2 Cu2O + 2SO2 ↑
Cu2S + 2 Cu2O → 6 Cu + SO2 ↑
गलित कॉपर के ऊपर से धातुमल की परत को हटाने के उपरान्त परिवर्तक को उलटकर गलित कॉपर को बाहर निकाल लेते हैं। इसे ठण्डा करने पर SO2 बुलबुलों के रूप में बाहर निकलती है। जिससे कॉपर की सतह पर फफोले पड़ जाते हैं। इस कॉपर को फफोलेदार कॉपर (blister copper) कहते हैं। इसमें लगभग 98% कॉपर तथा 2% अशुद्धियाँ (सल्फर, आर्सेनिक, आयरन, सिल्वर, गोल्ड आदि) होती हैं। इनको शोधन द्वारा पृथक् कर लेते हैं।
5. शोधन – अशुद्ध कॉपर को मुख्यत: वैद्युत-अपघटनी विधि द्वारा शुद्ध किया जा सकता है। इस प्रक्रम में एक टैंक में अशुद्ध ताँबे के पट लटका दिये जाते हैं। ये ऐनोड का कार्य करते हैं। शुद्ध ताँबे की पतली पत्तियाँ कैथोड का काम करती हैं। कॉपर सल्फेट का अम्लीय विलयन वैद्युत-अपघट्य के रूप में प्रयुक्त किया जाता है। वैद्युत धारा प्रवाहित करने पर कैथोड पर शुद्ध ताँबा जमा होता है तथा अशुद्धियाँ (लोहा, निकिल और जिंक) विलयन में रह जाती हैं। सोना या चाँदी अवक्षेप के रूप में ऐनोड के नीचे जमा हो जाते हैं, इनको ऐनोड पंक (Anode mud) कहा जाता है। इस प्रकार कैथोड पर शुद्ध (99.98%) ताँबा प्राप्त होता है।
प्रश्न 3.
ऐलुमिनियम के दो मुख्य अयस्कों के नाम तथा सूत्र लिखिए। बॉक्साइट के शुद्धिकरण की किसी एक विधि को संक्षेप में वर्णन कीजिए। ऐलुमिना से धातु कैसे प्राप्त की जाती है? (2010, 12, 14, 15, 16)
उत्तर
ऐलुमिनियम के दो मुख्य अयस्क-
- बॉक्साइट [Al2O5 . 2H2O]
- क्रायोलाइट [Na3AlF6]
बॉक्साइट के शुद्धिकरण को बेयर प्रक्रम – जब बॉक्साइट में Fe,05 की अधिक मात्रा होती है तो यह प्रक्रम प्रयुक्त होता है। इस प्रक्रम में बारीक पिसे बॉक्साइट को कॉस्टिक सोडा विलयन के साथ ऑटोक्लेव में 150°C तथा 80 वायुमण्डलीय दाब पर गर्म करते हैं। इस प्रकार Al2O3, सोडियम मेटाऐलुमिनेट में परिवर्तित हो जाता है, जो जल में घुलनशील है। अविलेय अशुद्धियों को विलयन से छानकर पृथक् कर लेते हैं। निस्यन्द में थोड़ा-सा नव-अवक्षेपित Al(OH)3 डालकर जल के साथ उबालते हैं। इससे सोडियम मेटाऐलुमिनेट जल-अपघटित होकर Al(OH)3 का अवक्षेप देता है। इस अवक्षेप को छानकर, धोकर सुखा , लेते हैं। इस सूखे अवक्षेप को गर्म करने से शुद्ध ऐलुमिना प्राप्त हो जाता है।

ऐलुमिना से धातु का निष्कर्षण – शुद्ध ऐलुमिना के वैद्युत अपघटने, जिसे इलेक्ट्रो अपचयन विधि भी कहते हैं, से ऐलुमिनियम धातु प्राप्त की जाती है। शुद्ध ऐलुमिना (Al2O3) का गलनांक 2050° C होता है। इसमें Na3AlF6 तथा CaF2 मिलाकर गर्म करने पर यह 875°C से 900°C के मध्य ही पिघल जाता है। Al2O3, Na3AlF6 तथा CaF2 के मिश्रण के गलित को कार्बन अस्तर लगे एक लोहे के पात्र में डालकर उसमें ग्रेफाइट की छड़े लटकायी जाती हैं। कार्बन अस्तर कैथोड तथा ग्रेफाइट छड़ ऐनोड का कार्य करती है। वैद्युत चक्र में समानान्तर क्रम में एक बल्ब लगाकर वैद्युत धारा प्रवाहित की जाती है जिससे ऐनोड पर ऑक्सीजन मुक्त होती है, जो ग्रेफाइट से क्रिया करके CO2 गैस के रूप में निकल जाती है। कैथोड (कार्बन अस्तर) पर ऐलुमिनियम धातु मुक्त होती है जिसे समय-समय पर एक छिद्र से बाहर निकाल लिया जाता है। ग्रेफाइट के ऐनोड के ऑक्सीकरण के कारण ग्रेफाइट समाप्त होती जाती है जिससे कुछ समय बाद नया ऐनोड लगाना पड़ता है। वैद्युत-अपघटन की क्रिया का रासायनिक समीकरण इस प्रकार है –
पहले क्रायोलाइट आयनित होता है।
Na3AIF6 3 Na+ + Al3+ + 6F–
Al3+ + 3e– → Al (कैथोड पर) (अपचयन)
2F – – 2e– → F2 (ऐनोड पर) (ऑक्सीकरण)
फ्लोरीन ऐलुमिना से क्रिया करके ऐनोड पर 02 मुक्त करती है।
2Al2O3 + 6F2 → 4AlF3 + 3O2 ↑
2C + O2 → 2CO
C + O2 → CO2
क्रायोलाइट की उपस्थिति में गलित ऐलुमिना के वैद्युत-अपघटन से लगभग 99.8% शुद्ध ऐलुमिनियम प्राप्त होता है।

प्रश्न 4.
सिल्वर (Ag) के निष्कर्षण की किसी एक विधि का वर्णन कीजिए। या सायनाइड प्रक्रम द्वारा चाँदी प्राप्त करने की विधि तथा आवश्यक रासायनिक समीकरण लिखिए। (2018)
उत्तर
सिल्वर धातु अत्यधिक क्रियाशील न होने के कारण प्रकृति में मुक्त तथा संयुक्त दोनों अवस्थाओं में पाई जाती है। इसके निष्कर्षण की विधि निम्नवत् है –
1. सान्द्रण – इसके सल्फाइड अयस्क को बाल मिल (Ball mill) में महीन पीसकर इसका झाग प्लवन विधि से सान्द्रण किया जाता है। एक टैंक में जल भरकर उसमें थोड़ा-सा चीड़ का तेल और थोड़ा-सा पोटैशियम एथिलजैन्थेट मिलाकर उसमें महीन पिसा हुआ सल्फाइड अयस्क डालकर वायु की तेज धारा द्वारा विलोडित करते हैं। सल्फाइड अयस्क झाग के रूप में द्रव के सतह के ऊपर तैरने लगता है और भारी अशुद्धियाँ टैंक की पेंदी में बैठ जाती हैं। फेन को अलग करके सुखाकर पीस लिया जाता है।
2. सायनाइड से अभिक्रिया – पिसे हुए सान्द्रित सल्फाइड अयस्क को एक छिद्रयुक्त पेंदी के टैंक में भर देते हैं। इस टैंक के भीतर किरमिच का अस्तर लगा होता है। अब अयस्क में 0.4 से 0.6% सोडियम सायनाइड का घोल मिलाकर हवा की तेज धारा प्रवाहित करते हैं और इस मिश्रण को तीव्रता से हिलाया जाता है। ऐसा करने से सल्फाइड अयस्क में उपस्थित सिल्वर, सायनाइड से क्रिया करके विलेयशील सोडियम डाइसायनोअर्जेन्टेट (I) संकर लवण बनाता है।
Ag2S + 4 NaCN 2 Na[Ag(CN2)]+ Na2S
सोडियम सल्फाइड वायु के द्वारा सोडियम सल्फेट में ऑक्सीकृत हो जाता है।
4Na2S + 5O2 + 2H2O → 2Na2SO4 + 4NaOH + 2S
सोडियम डाइसायनोअर्जेन्टेट (I) विलयन टैंक की पेंदी से टपकता रहता है जिसको एकत्रित करके फिर टैंक में डाल दिया जाता है। इस क्रिया को तीन-चार बार दोहराया जाता है जिससे सोडियम डाइसायनोअर्जेन्टेट (I) का सान्द्र विलयन प्राप्त हो जाता है।
3. सिल्वर का अवक्षेपण – सान्द्र डाइसायनोअर्जेन्टेट (I) विलयन को अवक्षेपण कक्षों में से प्रवाहित करते हैं। इन कक्षों में जिंक धातु की छीलन रखी होती है जो डाइसायनोअर्जेन्टेट (I) विलयन से सिल्वर को प्रतिस्थापित करके सिल्वर का काला अवक्षेप देता है और इस प्रकार से प्राप्त विलयन को छानकर सिल्वर का काला अवक्षेप पृथक् कर लेते हैं।
2Na[Ag(CN2] + Zn → Na2[Zn(CN4) + 2 Ag] ↓
सिल्वर को ऐलुमिनियम पाउडर द्वारा भी अवक्षेपित कराया जाता है।ऐलुमिनियम का उपयोग करने से सीधा ही सोडियम सायनाइड प्राप्त हो जाता है।
Al + 3Na[Ag(CN)2] + 4NaOH → 3Ag ↓ + 6NaCN + NaAlO2 + 2H2O
जिंक द्वारा अवक्षेपण करने में जो जिंक सायनाइड संकर बनता है वह बचे हुए सल्फाइड अयस्क को भी डाइसायनोअर्जेन्टेट (I) में परिवर्तित कर सकता है और इस प्रकार सायनाइड की हानि नहीं होती।
Ag2S+ Na2[Zn(CN)4] → 2Na[Ag(CN)2] + ZnS
प्रश्न 5.
गोल्ड (Au) के निष्कर्षण एवं शोधन की विधि का वर्णन कीजिए।
उत्तर
गोल्ड का शुद्धिकरण – गोल्ड का शुद्धिकरण निम्न विधियों द्वारा किया जाता है –
1. क्वार्टेशन विधि – इस विधि द्वारा कॉपर व सिल्वर की अशुद्धियों को हटाया जाता है। यह विधि
इस तथ्य पर आधारित है कि कॉपर व सिल्वर सल्फ्यूरिक व नाइट्रिक अम्लों में घुल जाते हैं, जबकि गोल्ड इन अम्लों के द्वारा प्रभावित नहीं होता। यदि अशुद्ध नमूने में गोल्ड 30% से अधिक है तो कॉपर व सिल्वर भी इन अम्लों के द्वारा प्रभावित नहीं होते। अतः इन अम्लों से अभिक्रिया करने से पहले नमूने को सिल्वर की आवश्यक मात्रा के साथ गलाते हैं जिससे नमूने में गोल्ड की प्रतिशत मात्रा 25% तक घट जाए। इसीलिए इसे क्वॉर्टेशन विधि कहते हैं। परिणामी मिश्र धातु को सान्द्र H,SO, के साथ प्रतिकृत करते हैं जिससे कॉपर व सिल्वर सल्फेटों के रूप में विलयन में आ जाते हैं, जबकि गोल्ड शेष रह जाता है। इस प्रकार से प्राप्त गोल्ड को बोरेक्स व KNOs के साथ गलित। करते हैं जिससे शुद्ध गोल्ड प्राप्त हो जाता है।
- Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
- 2Ag + 2H2SO4 → Ag2SO4 + 2H2O + SO2
(ii) विद्युत-अपघटनी विधि गोल्ड का शुद्धिकरण विद्युत अपघटनी विधि के द्वारा भी किया जा सकता है। इस विधि में गोल्ड क्लोराइड के विलयन जिसमें 10 – 20% HCl होता है का विद्युत-अपघटन किया जाता है। अशुद्ध गोल्ड ऐनोड के रूप में तथा शुद्ध गोल्ड कैथोड के रूप में किया जाता है। शुद्ध गोल्ड कैथोड पर एकत्रित हो जाता है, जबकि बने सिल्वर क्लोराइड को कीचड़ (mud) के रूप में हटा दिया जाता है।